-
新闻
细胞治疗 “终末关卡”:固定床生物反应器中EOPC的高效回收新解法
发布日期:2025-11-12
近年来,细胞治疗成为生物医药领域增长最快的赛道之一。随着全球政策支持与技术迭代,尤其是基因编辑等突破性进展,多个细胞治疗产品已成功获批。细胞作为抗体、蛋白药物、疫苗及细胞与基因治疗的“母体”,其质量、稳定性与种属真实性贯穿于研发、生产与临床应用全周期。一旦使用交叉污染或误识别的细胞,将导致研究结论失真、结果不可重复,甚至临床治疗失败,带来不可估量的损失与患者安全风险。为此,国际顶尖期刊如Nature、Science、Cell等多次呼吁加强对细胞的系统鉴定。
值得注意的是,2025年版《中华人民共和国药典》已于10月1日正式实施,其中明确规定需对初级细胞库(MCB)、主细胞库(WCB)及生产终末细胞(EOPC)或生产限定代次细胞进行鉴别试验,以确认细胞身份纯正、无交叉污染。这一要求将极大推动生物医药行业的标准化与规范化发展。
生产终末细胞(End of Production Cell Bank, EOPC)是指细胞培养结束时从反应器中取样的细胞样本。其核心作用在于通过冻存生产末期的细胞状态,用于后续的遗传稳定性和安全性检测,确保整个生产过程中细胞未发生不良变异。因此,EOPC应当进行一次全面的检定,当生产工艺变更时,应重新对EOPC进行检定。EOPC通过建库可追溯每批次生产过程,确保产品可溯源性。具体细胞检定项目(表1)。
表1. 细胞检定的基本要求
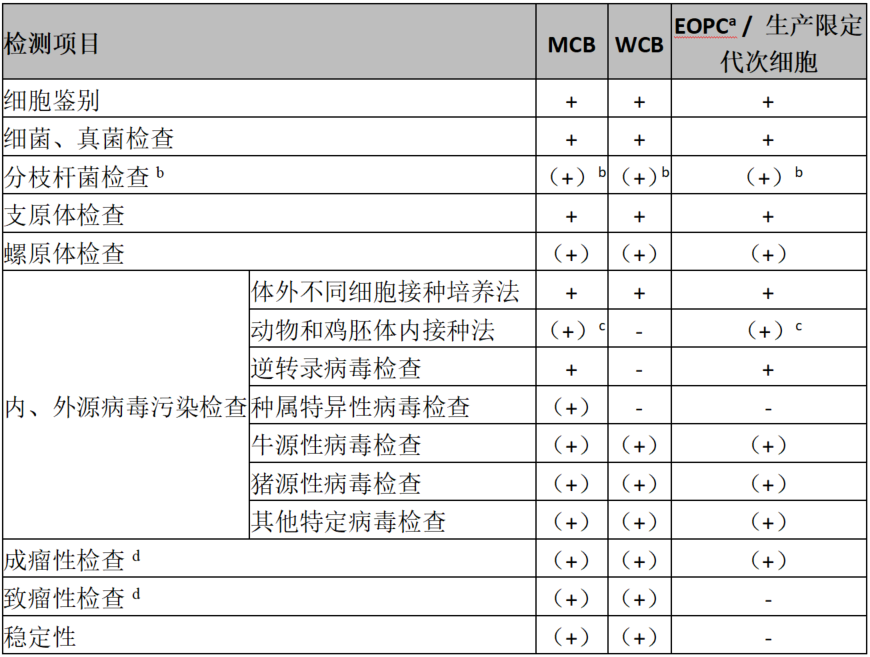
注:“+”为必检项目,“-”为非强制检定项目。(+)表示需要根据细胞特性、传代历史、培养过程等情况评估后进行的检定项目。
a.EOPC,是指达到或超过生产末期时收获的细胞,尽可能取按生产规模制备的生产末期细胞。
b.对分枝杆菌易感的细胞进行该项检查。
c.根据风险评估结果确定是否进行体内试验,如在建库或细胞培养过程中存在外源因子引入的风险,可进行体内试验或用经验证的NGS法替代。
d.从MCB或WCB复苏细胞,扩增至或超过生产用细胞龄限制代次作为待检样本。
固定床生物反应器:
细胞规模化生产的优选平台
固定床生物反应器(Fixed Bed Reactor, FBR)凭借其剪切力低、培养密度高、环境均一、易于放大等优势,成为贴壁细胞规模化生产的首选平台,广泛应用于病毒疫苗、细胞治疗、外泌体等高端生物制品领域,其技术正朝着智能化与集成化方向持续发展。
同腾新创CEL-G® Culture Ad60固定床生物反应器(Ad60 FBR)通过三维结构设计增大了比表面积,促进细胞生长与物质交换,其固定化培养方式可有效降低剪切力,延长细胞存活时间,适于长期培养。这些特性使FBR在慢病毒、溶瘤病毒、外泌体等制备中展现出广阔前景。尤其值得关注的是,同腾新创Ad60 FBR在EOPC回收方面表现优异,成功突破了传统三维培养中细胞回收效率低的技术瓶颈,为细胞治疗全工艺闭环提供了关键支撑。
在传统的二维(2D)培养中,可通过细胞消化处理轻松获得EOPC,用于细胞鉴定。然而,在三维(3D)固定床生物反应器中,细胞在膜结构中固定良好,传统的消化回收工艺效率往往不如悬浮和2D贴壁培养。EOPC的回收面临更大的技术挑战,这也为后续的细胞检定与质量追溯增加了难度。为克服这一瓶颈,同腾新创开发了在Ad60 FBR上的EOPC回收工艺,能够获取足够用于EOPC检测的细胞数量,具体案例如下:
案例1. Ad60 FBR BT-2 UC-MSCs
生产外泌体的EOPC收获
UC-MSCs细胞在Ad60 FBR BT-2/FB-2(2 m2)中进行2次固定化培养实验,分别培养9天和16天,在下罐收获细胞上清后,进行EOPC回收实验,通过PBS清洗和胰酶消化25分钟处理。结果显示:第一次实验第9天回收细胞活率为90.0%,细胞总数为3.0E+07;第二次实验第16天回收细胞活率为89%,细胞总数为3.5E+07。这表明在Ad60 FBR长期3D培养中细胞仍保持较高的细胞活率和回收效率,为延长外泌体收获时间与工艺一致性提供了有力保障(图1)。
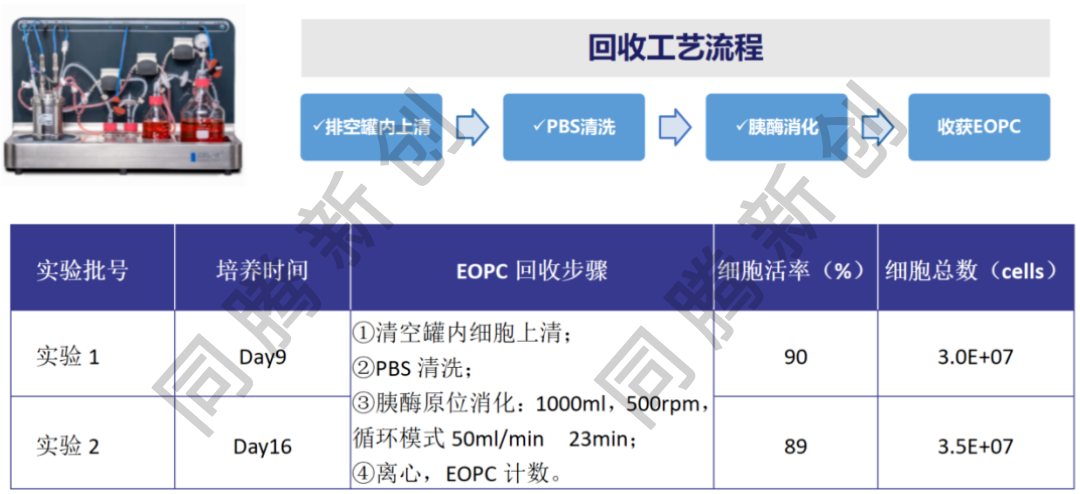
图1. UC-MSCs在Ad60 FBR BT-2的EOPC回收工艺流程和结果
案例2. Ad60 FBR BT-20 HEK293T
生产某种病毒载体的EOPC收获
HEK293T细胞在Ad60 FBR BT-20/FB-20(20 m2)中进行固定化培养。收获当天,对罐内细胞进行PBS清洗和胰酶消化处理。实验结果显示,细胞回收效果良好,回收细胞活率为90%,回收细胞总数为5.4E+08,完全满足后续检定所需(图2)。
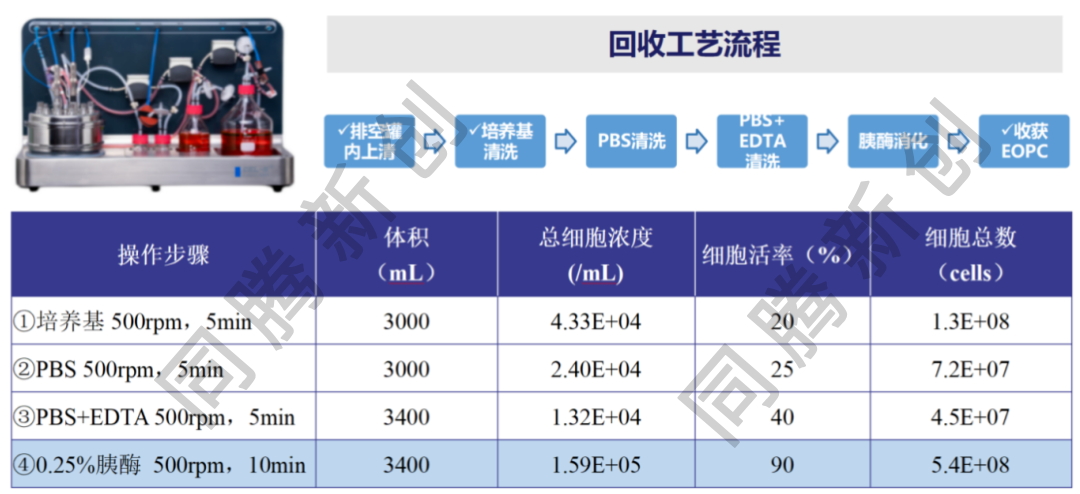
图2. HEK293T在Ad60 FBR BT-20的EOPC回收工艺流程和结果
结论
细胞和基因治疗作为生物医药领域增长最快的赛道之一,对细胞质量、可追溯性和一致性提出了更高要求。EOPC作为细胞库体系的重要一环,不仅是监管合规的关键节点,更是保障产品质量、工艺变更评估和非临床研究数据可靠性的“黄金标准”。
固定床生物反应器因其高密度培养与低剪切力优势,成为CGT领域生产制备的理想平台。同腾新创Ad60 FBR通过UC-MSCs与HEK293T的实验证实,其在3D培养后能够实现EOPC的高效回收,细胞活率高且收获量充足,满足检定要求,为病毒载体、外泌体等产品的规模化生产提供了可靠支撑。
随着基因编辑、个体化治疗与自动化技术的深度融合,细胞治疗工艺将向更封闭、更集成、更可追溯的方向发展。同腾新创Ad60 FBR凭借其在封闭系统内的高效扩增与回收能力,将持续为细胞治疗的商业化生产提供可靠、可落地、可放大的工艺解决方案,助力行业实现从研发到产业化的关键跨越。
[1] 国家药典委员会. 中华人民共和国药典:三部[S]. 2025年版. 北京: 中国医药科技出版社, 2025: 1088.
[2] U.S. Food and Drug Administration. Guidance for Industry: Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs)[S]. January 2020.
[3] European Medicines Agency. Guideline on quality, non-clinical and clinical aspects of medicinal products containing genetically modified cells[EB/OL]. 2020. https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-clinical-clinical-aspects-medicinal-products-containing-genetically-modified_en.pdf
[4] Heathman, T. R., et al. The translation of cell-based therapies: clinical landscape and manufacturing challenges[J]. Regenerative Medicine, 2015, 10(1): 49–64.
[5] Mount, N. M., et al. Cell-based therapy technology classifications and translational challenges[J]. Philosophical Transactions of the Royal Society B, 2015, 370(1680): 20150017.
[6] 国家药品监督管理局. 免疫细胞治疗产品药学研究与评价技术指导原则(试行)[EB/OL]. 2023. https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20230110138101117.html
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
