-
新闻
同腾新创固定床生物反应器助力iMSC-EVs标准化生产和在肺纤维化治疗中的临床转化!
发布日期:2025-11-21
近日,呈诺医学在《Stem Cell Research & Therapy》(IF=7.3)上发表了一项研究,该研究提出了一种标准化的生产平台,用于制造来源于诱导间充质干细胞(iMSCs)的细胞外囊泡(EVs),并验证了其在肺纤维化治疗中的潜力。

该研究不仅解决了传统EVs生产中存在的供体差异、扩增能力有限、质量不稳定等瓶颈问题,还通过同腾新创(苏州)科技有限公司自主研发的固定床生物反应器(CEL-G® Culture Ad60)实现了iMSC来源EVs的大规模、自动化生产(图1),以下为主要研究结果。

图1. 同腾新创GEL-G® Culture Ad60固定床生物反应器(Ad60 FBR)及适配的罐体
间充质干细胞衍生的
外囊泡的特性及应用
间充质干细胞外囊泡具免疫调节、抗炎及组织修复特性,是再生医学潜力无细胞疗法。其为纳米脂质囊泡,通过转运蛋白、脂质和核酸介导细胞通讯,在肺纤维化、心血管损伤等疾病中显治疗价值。相比细胞移植,安全性、生物分布及储存更优,且规避排斥和栓塞风险。但供体差异、可扩展性有限及生产流程不标准化等瓶颈阻碍临床转化,大规模生产需稳定细胞来源和生物工艺以满足GMP与临床需求,亟需标准化生产平台。
研究内容
研究人员从扩展多能干细胞(EPSCs)中生成并扩增间充质干细胞(MSCs),从而开发出一种可扩展的生物制造策略,随后使用固定床生物反应器进行诱导型间充质干细胞外囊泡(iMSC-EVs)的收获。通过标准化分离EVs,对其大小、形态、表面标志物和生物活性进行表征,并在博莱霉素诱导的肺纤维化小鼠模型中评估了其治疗效果。
研究结果
首先,研究人员从iPSCs经EPSCs、滋养层样干细胞(TLCs)最终分化为iMSCs(图2A)。通过流式细胞术分析(图2B),谱系特异性染色(图2C)及单细胞RNA测序分析(图2D),确认了iMSCs替代MSC来源的可行性及其功能和表型的一致性,表明iMSCs保留了原代MSCs的结构和功能特征。
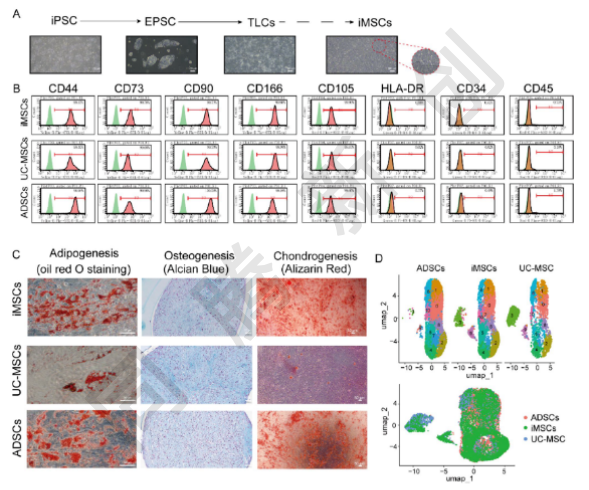
图2. iMSC的生成、表征及其多向分化潜能
通过在P6、P8和P12代次的对比显微镜图像展示(图3A),三种MSC在整个传代过程中均保持典型的成纤维细胞样纺锤形态,未见明显衰老迹象或形态异常。流式细胞术分析(图3B)及核型分析(图3C)证明了其表型稳定性与基因组稳定性。CCK-8法测定(图3D)证实了它们在体外扩增过程中的持续增殖能力。这些发现表明,iMSCs不仅在较高传代时保持稳定的MSCs表型和核型,而且在表现出更大的基因组和表型稳定性的同时保持增殖能力。
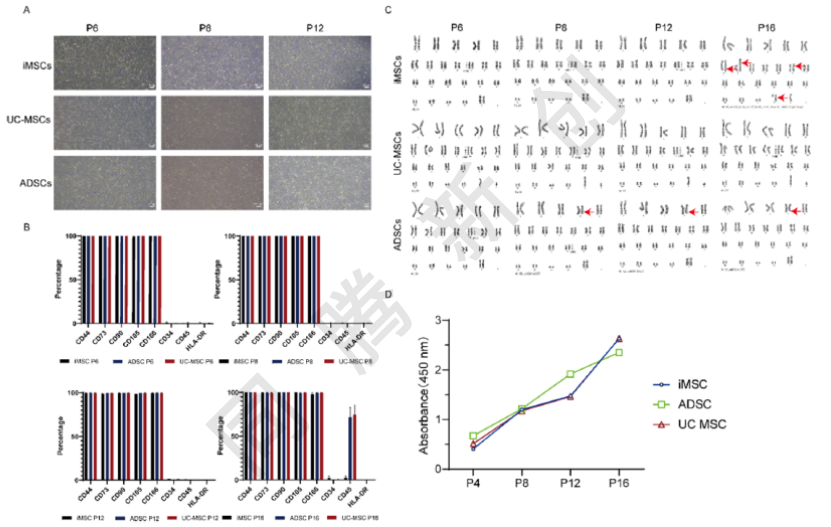
图3. iMSC、UC-MSC与ADSC多次传代的稳定性表征
本研究使用CEL-G® Culture Ad60构建了培养面积为 2 m2的固定床生物反应器系统,用于实现MSCs与iMSCs来源细胞EVs的高效生产。该工作流程整合了冻存工作细胞库、固定床反应器细胞接种、EVs上清液的连续收集,以及后续的切向流过滤纯化系统(图4A)。在接种后的第7天和第14天从反应器中取取样条,对MSCs与iMSCs取样条进行结晶紫染色观察(图4B),显示随时间推移细胞逐步增殖并覆盖膜材。通过活死细胞染色(图4C),显示两种细胞均呈现高存活率与极低死亡率,表明固定床生物反应器内培养环境稳定。流式细胞术分析(图4D)证实了iMSCs及MSCs表型在整个扩增过程中保持稳定。同时,测量了从生物反应器收集的上清液的日体积和纯化EVs的产量(图4E)。研究人员每天从MSCs和iMSCs的固定床培养体系中收获约600-700 mL的条件培养基,两组之间没有显著差异。切向流过滤后,将该体积浓缩至50-60 mL,得到相当的EVs悬浮液。纳米颗粒追踪(图4F)显示,MSCs的日产量约为1.5×1013 particles,iMSCs的日产量为1.2×1013 particles,证实了这两种细胞源具有等效的EVs生产能力。
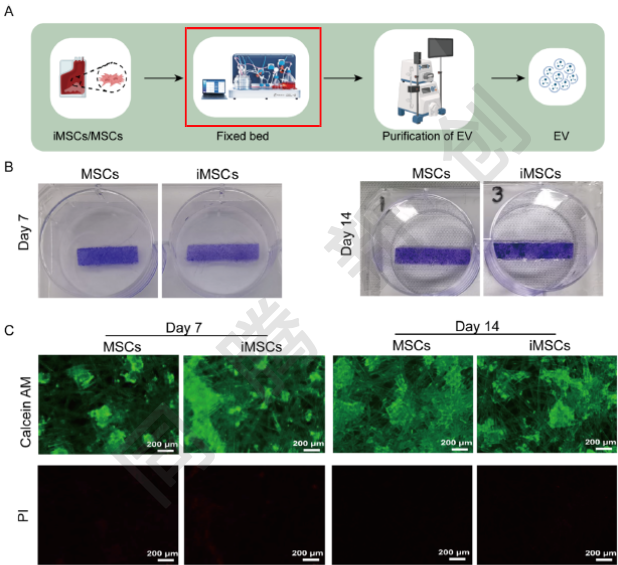
图4. 利用Ad60 FBR系统实现MSC与iMSC来源细胞EVs的规模化生产及特性分析
通过测量骨髓源性巨噬细胞(BMDM)中促炎细胞因子的表达来评估iMSC EVs和MSC EVs的促炎潜力。巨噬细胞分别经iMSC-EVs、MSC-EVs或LPS(阳性对照)处理4小时后,通过qRT-PCR分析TNFα、IL1β和IL6的mRNA表达水平(图5A)。结果显示,iMSC EVs和MSC EVs均未诱导显著的细胞因子表达,这表明这两种EVs类型都缺乏促炎活性。为了评估EVs的抗炎潜力,巨噬细胞先经iMSC-EVs或MSC-EVs预处理2天,再接受LPS刺激,随后通过qRT-PCR分析炎症因子表达(图5B)。结果显示,这两种EVs类型都表现出抗炎特性,支持了它们对炎症和免疫相关疾病的治疗潜力。
研究人员进一步在体内评估了iMSC EVs和MSC EVs的系统安全性。
小鼠于第0、2、4、6、8、10天经静脉注射iMSC-EVs或MSC-EVs(1011 particles/dose),第13天处死进行安全性评估(图5C)。小鼠体重监测(图5D)、肝功能指标水平检测(图5E、F)及主要器官组织病理学分析(图5G)均证明iMSC EVs和MSC EVs是安全的,不会在体外引发炎症反应或在体内引起不良反应。此外,这两种EVs类型都表现出抗炎特性。这些发现突显了EVs作为免疫相关和炎症性疾病治疗剂的潜力。
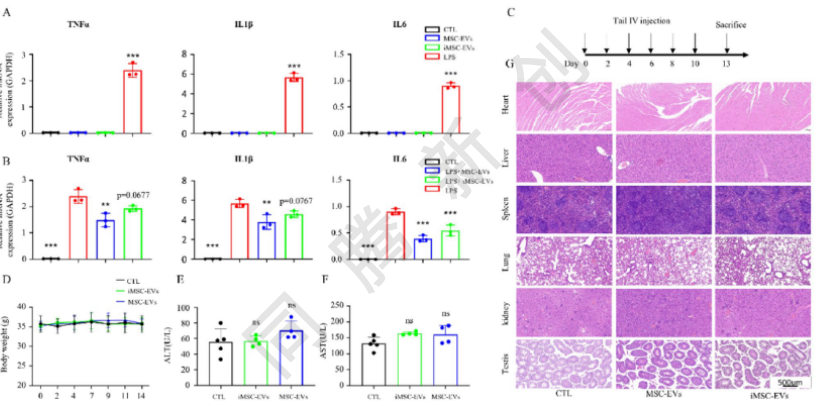
图5. iMSC-EVs与MSC-EVs的免疫调节效应及系统安全性评估
为了评估iMSC-EVs和MSC-EVs治疗肺纤维化的治疗潜力,研究人员通过气管内滴注EVs给博莱霉素(BLM)诱导的肺纤维化小鼠模型(图6A)。体重监测显示(图6B),iMSC EVs和MSC-EVs均有效地减轻了纤维化引起的体重减轻。H&E染色(图5C)、Masson三色染色(图6D)及天狼星红染色(图6E)均显示,iMSC EVs和MSC EVs都能有效减轻纤维化并恢复肺结构。肺纤维化程度量化结果(图6F)及支气管肺泡灌洗液(BALF)总蛋白水平结果证实,两个EVs治疗组之间没有显著差异,疗效相当。这些结果均证明,iMSC-EVs与MSC-EVs在缓解博来霉素诱导的小鼠肺纤维化方面具有相当的治疗效力,这两种细胞外囊泡均可作为治疗纤维化肺疾病的有效治疗制剂。
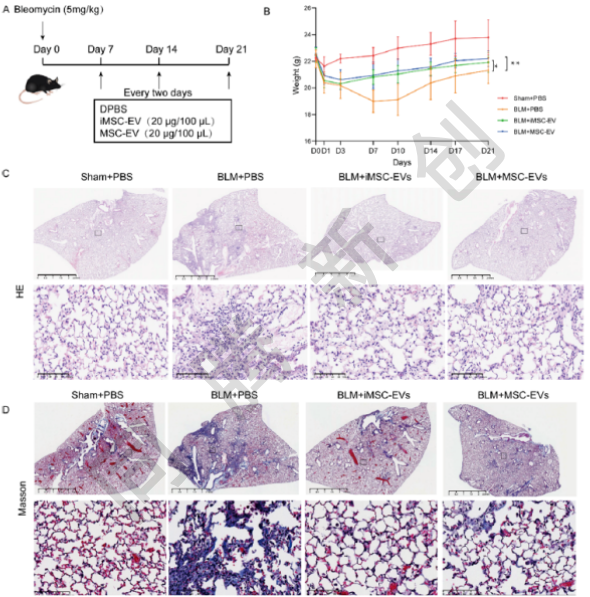
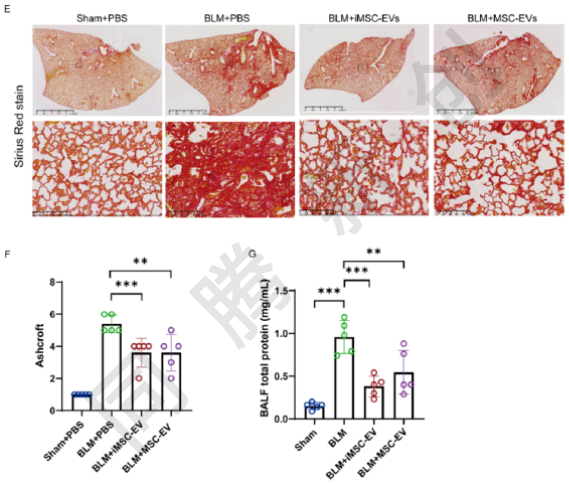
图6. iMSC-EVs与MSC-EVs在博来霉素诱导的小鼠肺纤维化模型中的治疗效果
结论
在再生医学领域,间充质干细胞来源的细胞外囊泡因其免疫调节、抗炎及组织修复功能,被视为极具潜力的无细胞治疗策略。然而,其临床应用长期受限于供体差异性、有限的可扩展性及批次间质量不一致等关键瓶颈。为解决这一难题,本研究确立了iMSC-EVs作为一种可规模化、质量稳定且疗效确切的治疗工具,不仅适用于肺纤维化,更具备治疗其他炎症性与纤维化疾病的潜力。通过解决细胞外囊泡生产中的关键挑战——包括规模化生产与功能一致性,iMSC-EVs已成为原代MSC-EVs的可行替代方案。
同腾新创的Ad60 FBR是一个集成的、计算机控制的封闭系统,能实现持续生产和线性放大,可将MSC和iMSC转化成一个高效、可控、可放大的EVs生产系统。该技术完美地解决了MSC和iMSC来源EVs在迈向临床治疗道路上的核心瓶颈——产量、质量、一致性和成本问题,为新一代无细胞再生疗法的标准化工艺开发奠定了重要基础。
直播预告
呈诺医学最新研究成果重磅登刊国际权威期刊《Stem Cell Research & Therapy》(IF=7.3),12 月 4 日(周四)19:30,同腾新创(苏州)科技有限公司工艺开发应用科学家冯秋萍将深度拆解《固定床生物反应器助力呈诺医学 iMSC-EVs 标准化生产与临床转化》的核心技术,解读临床转化实践价值。这场干货满满的技术盛宴,诚邀你共赴!
主题名称:固定床生物反应器助力呈诺医学iMSC-EVs标准化生产和临床转化!
直播时间:2025年12月04日-19:30
直播平台:同腾生物微信视频号
参会方式:线上

- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
