-
新闻
案例应用丨外囊泡变身“超速快递员”:CD63工程化外囊泡助力基因治疗载药与递送
发布日期:2025-07-18
随着基因治疗和基因编辑技术的飞速发展,对载体系统的要求也日益提高。传统非整合载体,例如腺相关病毒(AAV)以及合成mRNA纳米颗粒,在长期表达的安全性与编码容量方面存在诸多限制[1]。而细胞外囊泡(EVs)凭借其天然的细胞间通讯功能,展现出作为治疗载体的巨大潜力。不过,EVs的异质性、较低的载药效率以及复杂的纯化流程,阻碍了其广泛应用。EVs堪称天然的细胞间通讯“快递员”,但如何使这些“快递员”能够精准地装载并投递治疗性“货物”,一直是科学家们亟待解决的难题。值得庆幸的是,哈佛医学院团队于2025年6月17日在《Journal of Extracellular Vesicles》杂志上发表了一项名为《Engineering of CD63 Enables Selective Extracellular Vesicle Cargo Loading and Enhanced Payload Delivery》的研究成果[2],为这一领域带来了突破性的进展!
本研究通过工程化改造CD63跨膜蛋白,成功富集了携带特定货物的EV。改造后的CD63即E-NoMi,其mCherry位于EV膜内侧,3xFLAG标签暴露于膜外侧。借助mCherry特异性纳米抗体(Nb)与目标蛋白(如EGFP/Cre/SaCas9)融合,实现了EVs的高效载药。为提升EV的递送效率,研究人员将水泡性口炎病毒G糖蛋白(VSV-G)融合蛋白掺入E-NoMi-EV,构建出基于融合的EV载体(EVV),EVV的货物递送效率较尺寸排阻色谱产生的EV高出10倍。此外,利用烟草蚀纹病毒(TEV)位点,研究人员去除了E-NoMi-EVV外部的3xFLAG标签和NanoLuc,生成了无瑕疵的EVV载体。在两个小鼠大脑模型中,E-NoMi-EVV展现出高效的功能性载药递送能力,为基因治疗和基因编辑领域提供了全新的工具,有望推动相关技术在疾病治疗中的应用。

EVs是一种天然的双层膜结构,能够通过传递核酸、脂质和蛋白质来介导细胞间的通讯。然而,其异质性特征在一定程度上限制了其在基因治疗领域的应用潜力[3]。与此同时,传统非整合载体(如AAV)存在表达时间短、编码容量有限等问题,而EVs则面临着载货效率低、分离纯化困难以及缺乏靶向递送能力等挑战。为了克服这些难题,本研究巧妙地通过工程化改造跨膜蛋白CD63,成功构建出了E-NoMi,从而实现了EVs的高效选择性载货与精准递送。
双报告基因标记的CD63工程化(E-NoMi)
膜外层:通过3xFLAG标签实现免疫捕获,以及利用NanoLuc荧光素酶进行定量标记。
膜内层:以mCherry荧光蛋白作为“货物手柄”,与纳米抗体Nb结合,实现精准装载。
启动子优化:采用EF-1α启动子增强表达,命名为E-NoMi-Red。
模块化载货系统
将目标蛋白(如EGFP、Cre重组酶、SaCas9)与抗mCherry的Nb融合,利用mCherry-Nb亲和力,将货物主动装载到EVs管腔中 。
载货效率显著提升:与非特异性Nb相比,抗mCherry Nb使EVs的载货率从3.6%大幅跃升至55.3%,实现了13倍的提升。
免疫捕获与纯化
通过3xFLAG标签磁珠富集载货EVs,再经TEV位点去除E-NoMi-EVV外部的3xFLAG标签和NanoLuc,生成无瑕疵的EVV载体。
融合蛋白增强递送效率
引入水泡性口炎病毒G糖蛋白(VSV-G),构建融合型EV载体(EVVs),使其递送效率比传统尺寸排阻色谱(SEC)分离的EVs提高10倍。
通过工程化改造CD63蛋白,利用E-NoMi(pCDH-EF1-E-NoMi-P2A-CopGFP-T2A-PuroR,addgene #207805)系统,实现EVs的选择性载货与高效富集。研究人员设计了多种质粒,其转基因编码的蛋白载荷(如EGFP、Cre重组酶、SaCas9)分别融合到抗mCherry纳米抗体(Nb),以实现精准装载。作为对照,生成了与不靶向mCherry的抗ALFA标签Nb融合的EGFP和Cre变体。为了确保装载效率的评估不受其他荧光蛋白的干扰,研究人员从E-NoMi系统中移除了P2A-copGFP元件,生成了E-NoMi-Red,其中“E”表示EF-1α启动子,“NoMi-Red”突出了mCherry在EVs内膜侧的存在,作为mCherry Nb结合的系绳。基于CD63的E-NoMi-Red系统,开发了一种分离策略,通过两步法从细胞培养基中分离EVs/EVVs:首先使用快速离心过滤器生成高浓度EV悬浮液,然后通过基于磁珠的3xFLAG标签免疫捕获技术,有效去除了未指定货物的游离蛋白质和EVs/EVVs(Figure 1)。
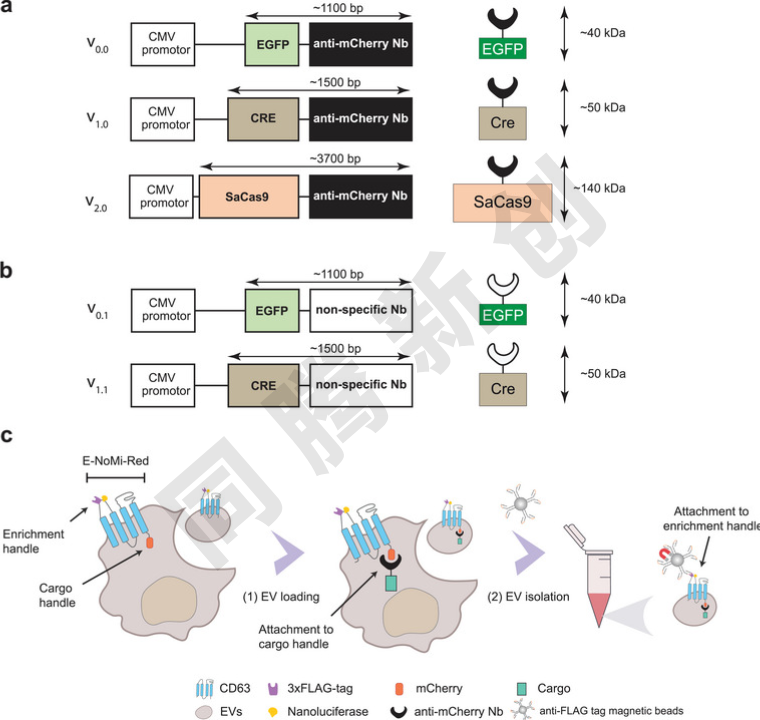
Figure 1. 抗mCherry纳米抗体(Nb)介导的EV靶向载药机制
实验结果表明,这种工程化的EVs在装载效率上显著提升。通过免疫捕获技术,研究人员能够从细胞培养上清中分离出高达73%的E-NoMi-EVs。与传统的尺寸排阻色谱法(SEC)相比,免疫捕获的EVs在NanoLuc信号(一种用于检测EVs的荧光标记)上高出3.4倍,这意味着免疫捕获法能够更有效地富集装载了特定“货物”的EVs。此外,研究人员还发现,使用抗mCherry Nb融合的Cre重组酶装载的EVs,其装载效率比使用非特异性Nb的EVs高出13倍以上。这表明,通过特异性Nb与mCherry的结合,能够极大地提高EVs的装载效率(Figure 2)。
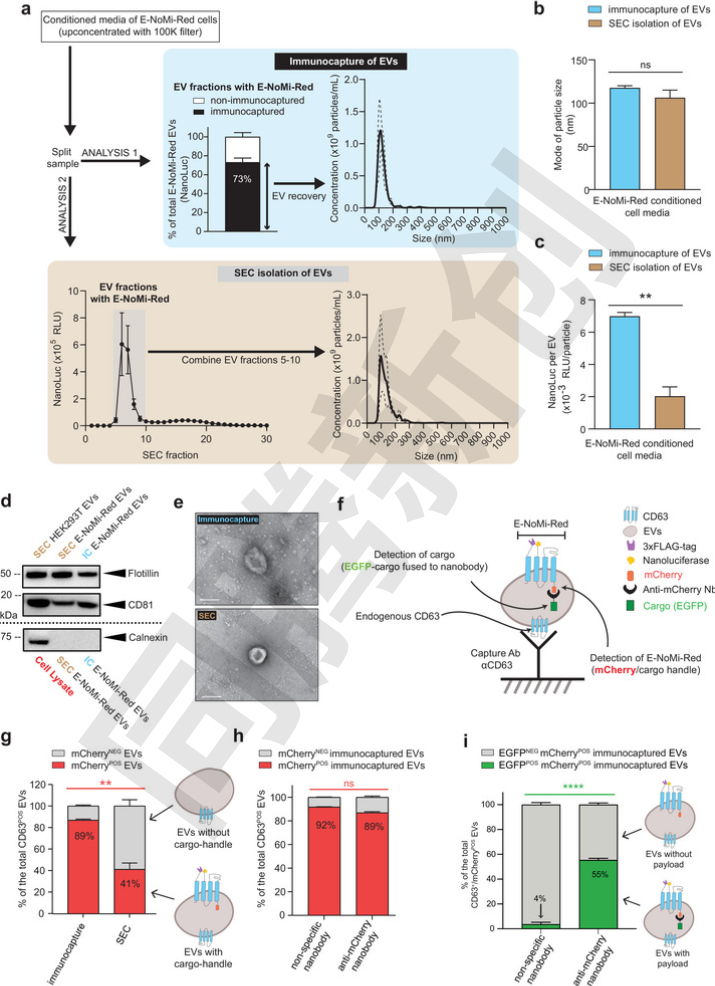
Figure 2.抗mCherry纳米抗体介导的EVs载药效率对比(免疫捕获 vs SEC)
为了进一步提高EVs的“投递”效率,研究人员在EVs表面融合了VSV-G,这种蛋白能够促进EVs与细胞膜的融合,从而帮助EVs更有效地将“货物”释放到目标细胞中。实验结果令人振奋,与传统EVs相比,融合了VSV-G的EVVs在Cre重组酶的传递效率上提高了10倍。在小鼠脑部模型中,研究人员将装载了Cre重组酶的EVVs注射到小鼠脑内,发现这些EVVs能够有效地将Cre重组酶传递到目标细胞中,并诱导基因表达的变化。这一结果表明,工程化的EVVs在体内也具有高效的“投递”能力(Figure 3)。
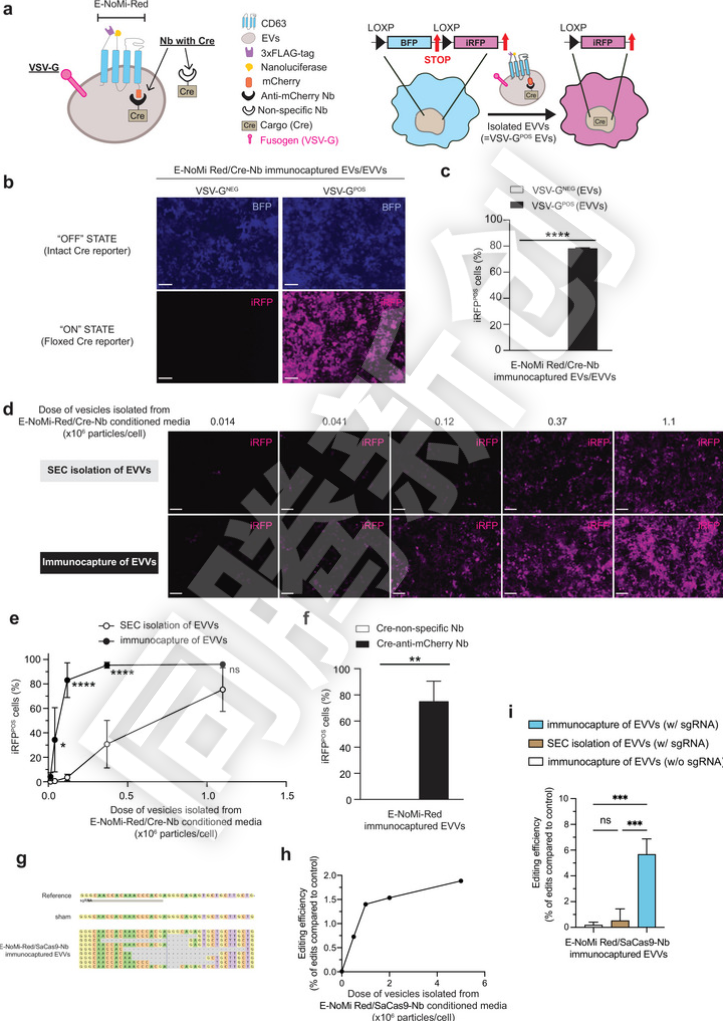
Figure 3.E-NoMi-Red EVV 是有效的基因治疗载体
通过工程化改造,EVs能够高效地装载并传递多种治疗性蛋白,这为治疗各种遗传性疾病和癌症等提供了新的可能性。此外,研究人员还通过TEV位点去除EVs表面的免疫捕获标签,从而避免潜在的免疫反应,这对于EVs的临床应用至关重要(Figure 4)。
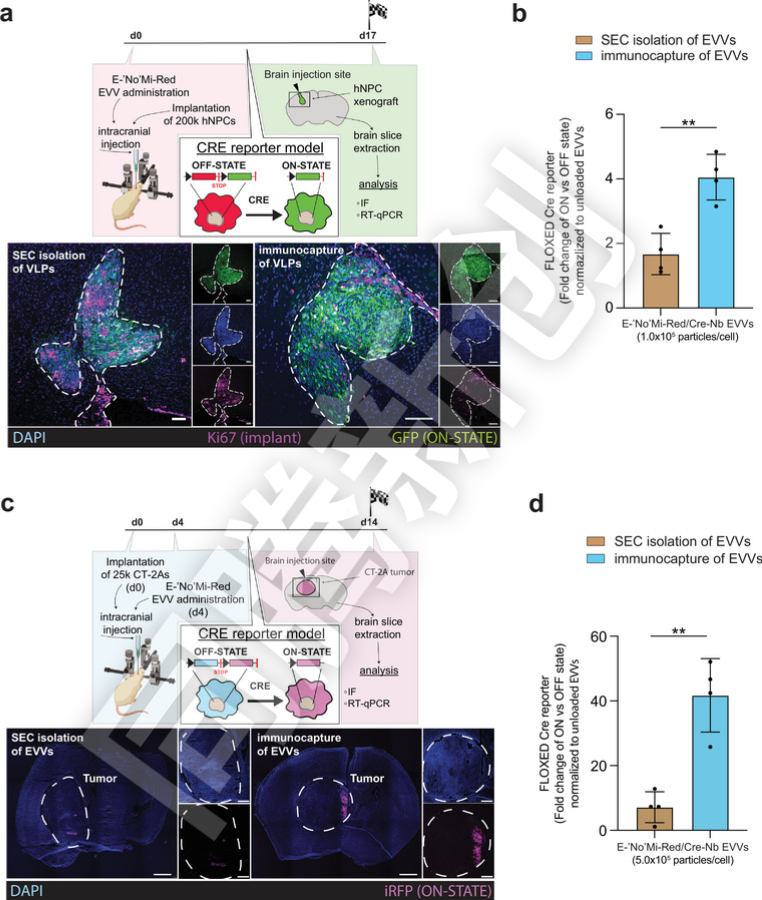
Figure 4.体内脑植入模型中的 E-NoMi-Red EVV
本研究通过工程化改造CD63跨膜蛋白,构建了E-NoMi,实现了EVs的高效选择性载货与精准递送。E-NoMi利用mCherry荧光蛋白作为“货物手柄”,通过其特异性纳米抗体(Nb)与目标蛋白(如EGFP/Cre/SaCas9)融合,使EVs的载货率显著提升,与非特异性Nb相比,抗mCherry Nb使EVs的载货率从3.6%大幅跃升至55.3%,实现了13倍的提升。同时,借助3xFLAG标签磁珠富集载货EVs,并通过TEV位点去除E-NoMi-EVV外部的3xFLAG标签和NanoLuc,生成无瑕疵的EVV载体。此外,通过VSV-G构建融合型EV载体(EVVs),使其递送效率比传统尺寸排阻色谱(SEC)分离的EVs提高10倍。在小鼠脑部模型中,E-NoMi-EVV展现出高效的“投递”能力,能够有效地将Cre重组酶传递到目标细胞中,并诱导基因表达的变化。尽管取得了显著进展,但工程化EVs的生产工艺仍需进一步优化以提高产量。
为满足工程化EVs规模化生产需求,同腾新创研发了CEL-G® Culture Ad60系列固定床生物反应器(Ad60 FBR,Figure 5)。该设备集成了介质流动、气体交换、温度、pH和溶解氧(DO)的智能调控系统,可确保稳定的细胞培养环境参数。Ad60 FBR采用PET膜与PP网交替缠绕的3D培养结构,提供1-60㎡可扩展培养面积,其放大型CEL-G®Culture Ad600系列固定床生物反应器最大可扩展至600㎡(Figure 6)。通过独特的低剪切力培养环境和优化的3D基质结构,不仅显著促进细胞生长,更大幅提升了EVs的产量。

Figure 5. CEL-G® Culture Ad60 BT-2(左)和 BT-20(右)固定床反应器
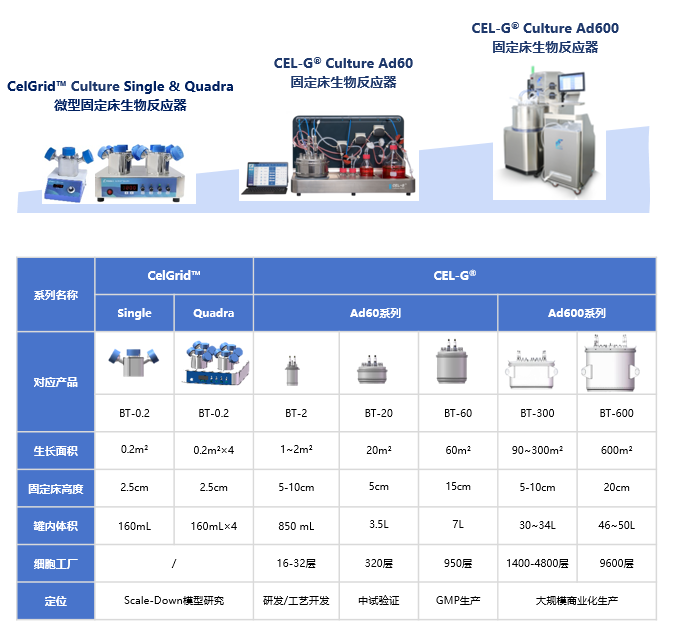
Figure 6 .CEL-G® & CelGrid™ 系列固定床生物反应器及定位
案例应用:工程化EVs在Ad60 FBR
的稳定和高效生产
采用Ad60 FBR 20㎡ 膜面积对工程化HEK293T细胞进行无血清连续培养,58天培养周期内累计完成18批次细胞上清生产,获得细胞上清总量达700多升。经纳米流式检测法(Flow NanoAnalyzer),各批次上清中EVs颗粒浓度和粒径大小稳定,最终实现工程化EVs总产量9.5×1014 particles。该数据证实了Ad60 FBR在工程化EVs规模化生产中的稳定性和高效性。
同腾新创CEL-G® Culture Ad60系列固定床生物反应器为工程化EVs的大规模生产提供了完整的解决方案。该设备采用独特的3D培养设计,通过低剪切力环境支持多种细胞的高密度培养,同时实现工程化EVs的高效收获。其全封闭自动化生产结合智能控制系统,可精准优化培养条件,显著降低污染风险,确保细胞健康状态和EVs的稳定分泌。该设备支持连续培养和多批次收集,不仅提高了生产效率,还能减少批次差异,保证工程化EVs的质量均一性,符合GMP标准要求,为工程化EVs的标准化、规模化生产开辟了新途径。
[1] George, L. A. , Ragni M. V., Rasko J. E. J., et al. 2020. “Long‐Term Follow‐Up of the First in Human Intravascular Delivery of AAV for Gene Transfer: AAV2‐hFIX16 for Severe Hemophilia B.” Molecular Therapy: The Journal of the American Society of Gene Therapy 28, no. 9: 2073–2082. 10.1016/J.YMTHE.2020.06.001.
[2] Obuchi W, Zargani-Piccardi A, Leandro K, Rufino-Ramos D, Di Lanni E, Frederick DM, Maalouf K, Nieland L, Xiao T, Repiton P, Vaine CA, Kleinstiver BP, Bragg DC, Lee H, Miller MA, Breakefield XO, Breyne K. Engineering of CD63 Enables Selective Extracellular Vesicle Cargo Loading and Enhanced Payload Delivery. J Extracell Vesicles. 2025 Jun;14(6):e70094. doi: 10.1002/jev2.70094. PMID: 40527733; PMCID: PMC12173531.
[3] Du, R. , Wang C., Zhu L., and Yang Y.. 2022. “Extracellular Vesicles as Delivery Vehicles for Therapeutic Nucleic Acids in Cancer Gene Therapy: Progress and Challenges.” Pharmaceutics 14, no. 10: 2236. 10.3390/PHARMACEUTICS14102236.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
