-
新闻
免疫衰老逆转+细菌智能绞杀!外泌体微针贴片为糖尿病难治性感染带来曙光
发布日期:2025-06-05
糖尿病患者一旦出现术后感染,往往意味着漫长的治疗周期和更高的并发症风险。尤其是关节置换术后易发的“假体周围感染(PJI)”[1-2]。2025年4月,浙江大学医学院团队在《Journal of Controlled Release》发表的最新研究《Fate reversal: Exosome-driven macrophage rejuvenation and bacterial-responsive drug release for infection immunotherapy in diabetes》带来了一种革命性的治疗策略 ——外泌体微针贴片 ExoV-ExoL@MN,它能同时解决糖尿病感染中的两大核心难题:免疫衰老和细菌侵袭,为糖尿病相关感染的防治开辟了新路径(Figure 1)。

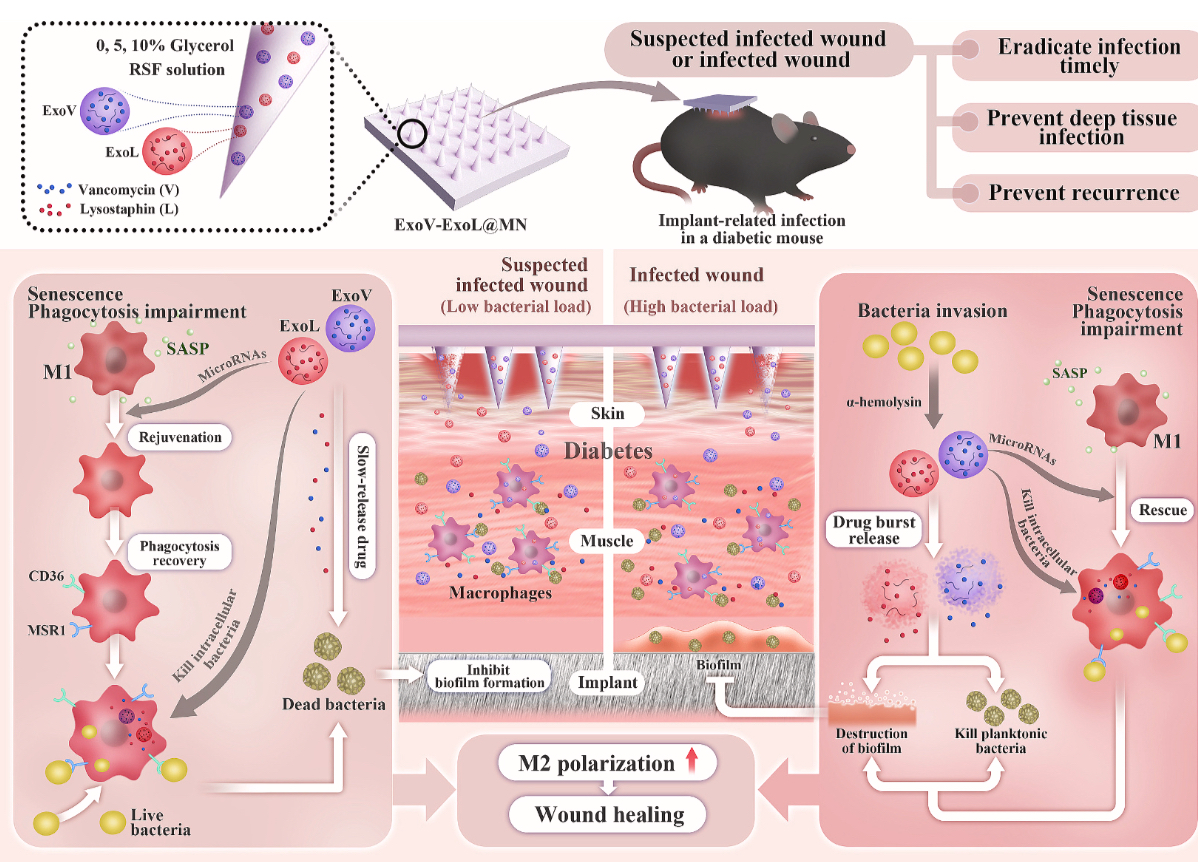
Figure 1. ExoV-ExoL@ MN介导的免疫疗法预防和治疗糖尿病小鼠中SSI诱导的IRI的示意图。
综述亮点:
-
手术部位浅表感染是糖尿病患者假体周围关节感染的重要危险因素;
-
高葡萄糖驱动巨噬细胞衰老并抑制抗微生物免疫;
-
外泌体治疗使巨噬细胞恢复活力并逆转免疫抑制环境;
-
负载抗生素的外泌体能够实现靶向递送和有效的细菌清除;
-
可定制的微针贴片控制释放,使量身定制的临床治疗。
糖尿病患者术后感染的问题之所以棘手的根本原因在于高糖环境下的免疫抑制(Figure 2)。正常情况下,巨噬细胞作为感染的第一反应者,在识别、吞噬和消除病原体方面发挥着关键作用[3-4]。但在糖尿病患者体内,高血糖会迫使巨噬细胞进入衰老模式,其具体表现为:其一是吞噬能力暴跌,在高糖环境下,巨噬细胞表面的吞噬受体(如 CD36、MSR1)表达下调,对细菌的识别和吞噬效率显著降低。其二是炎症失控循环,衰老的巨噬细胞会持续分泌炎症因子(如 TNF-α、IL-6),形成无效炎症,既无法清除细菌,又会损伤周围组织[5]。其三是修复能力瘫痪,巨噬细胞无法从促炎的 M1 表型转换为抗炎的 M2 表型,伤口愈合进程严重受阻[6-7]。
与此同时,金黄色葡萄球菌等致病菌还会形成生物膜,进一步躲避药物攻击。传统抗生素治疗面临两大困境:全身用药毒性大,局部用药又难以穿透生物膜且易引发耐药性。因此,如何同时解决免疫抑制和细菌感染两大难题,成为治疗糖尿病相关感染的关键。
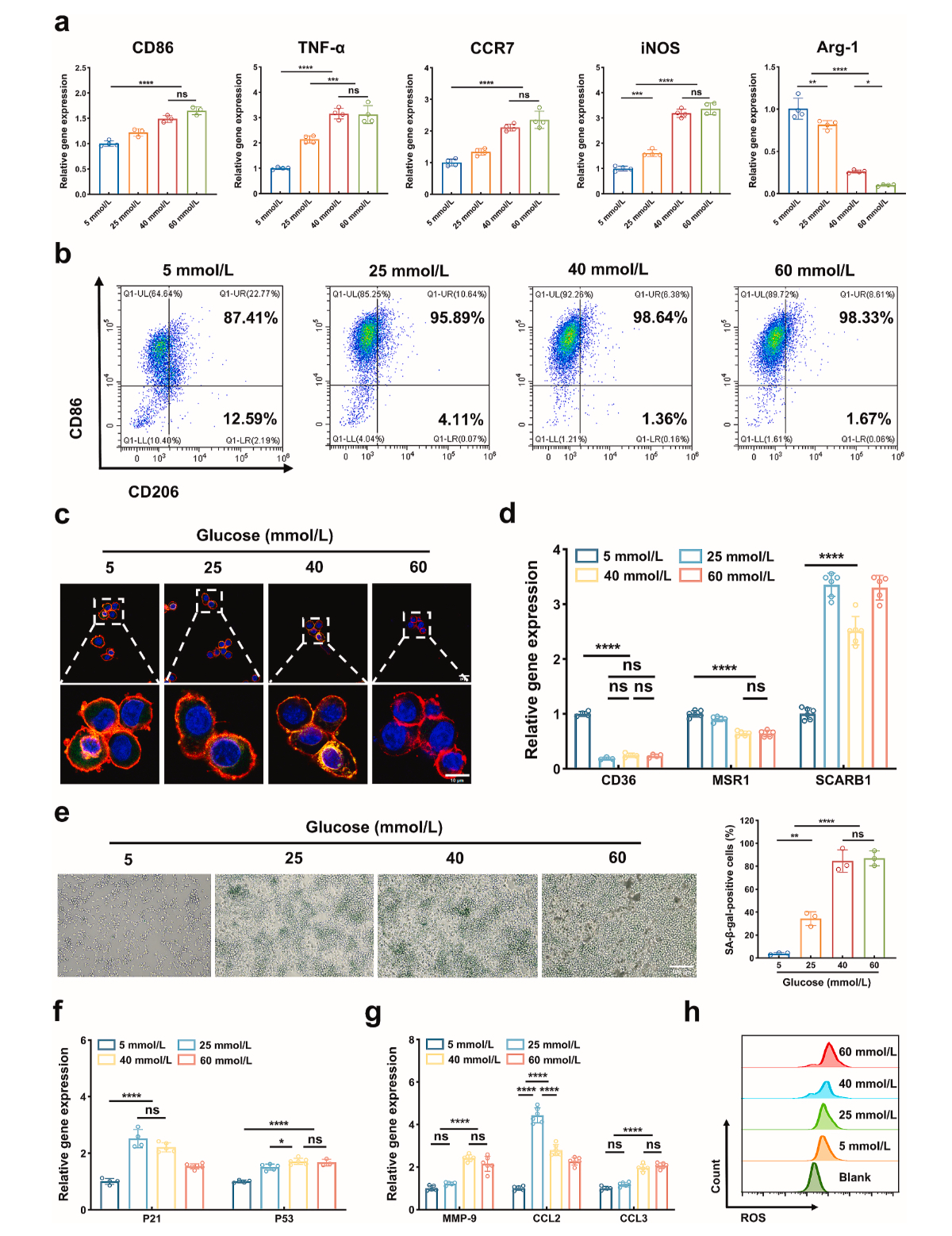
Figure 2. 高糖诱导的巨噬细胞衰老损害吞噬作用,导致免疫抑制。
来源于间充质干细胞的外泌体(MSC-Exos)已显示出减弱各种组织中的细胞衰老,减少衰老标志物的分泌,减少SASP因子,并增强细胞增殖[8-9]。研究团队从脐带间充质干细胞中提取外泌体(H-Exos),其含有生物活性分子,例如蛋白质、RNA和微小RNA(miRNA),能逆转巨噬细胞衰老,恢复其吞噬能力,重塑免疫微环境(Figure 3-4)。
-
巨噬细胞逆龄术:H-Exos 能显著降低衰老标志物 SA-β-gal,减少衰老相关p21、p53 的表达,使衰老巨噬细胞的比例减少 50% 以上。
-
吞噬功能重启:恢复 CD36、MSR1 等受体表达,让巨噬细胞的细菌吞噬率从 3.69% 提升至 12.35%。
-
炎症刹车系统:促进巨噬细胞从 M1 向 M2 表型转换,抗炎因子 Arg-1 表达增加,促炎因子 TNF-α 显著下降。
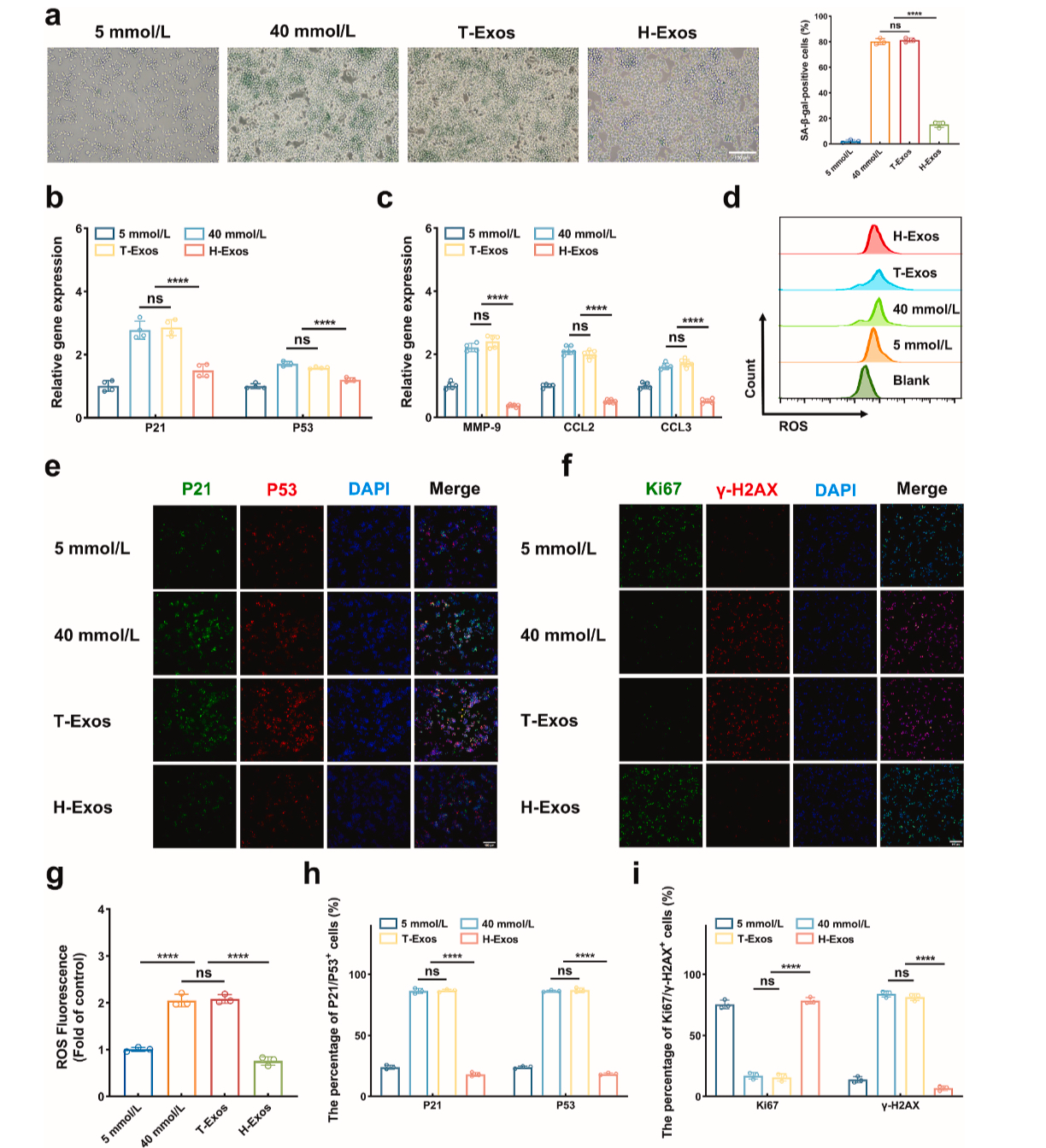
Figure 3. H-Exos使巨噬细胞的衰老表型恢复活力
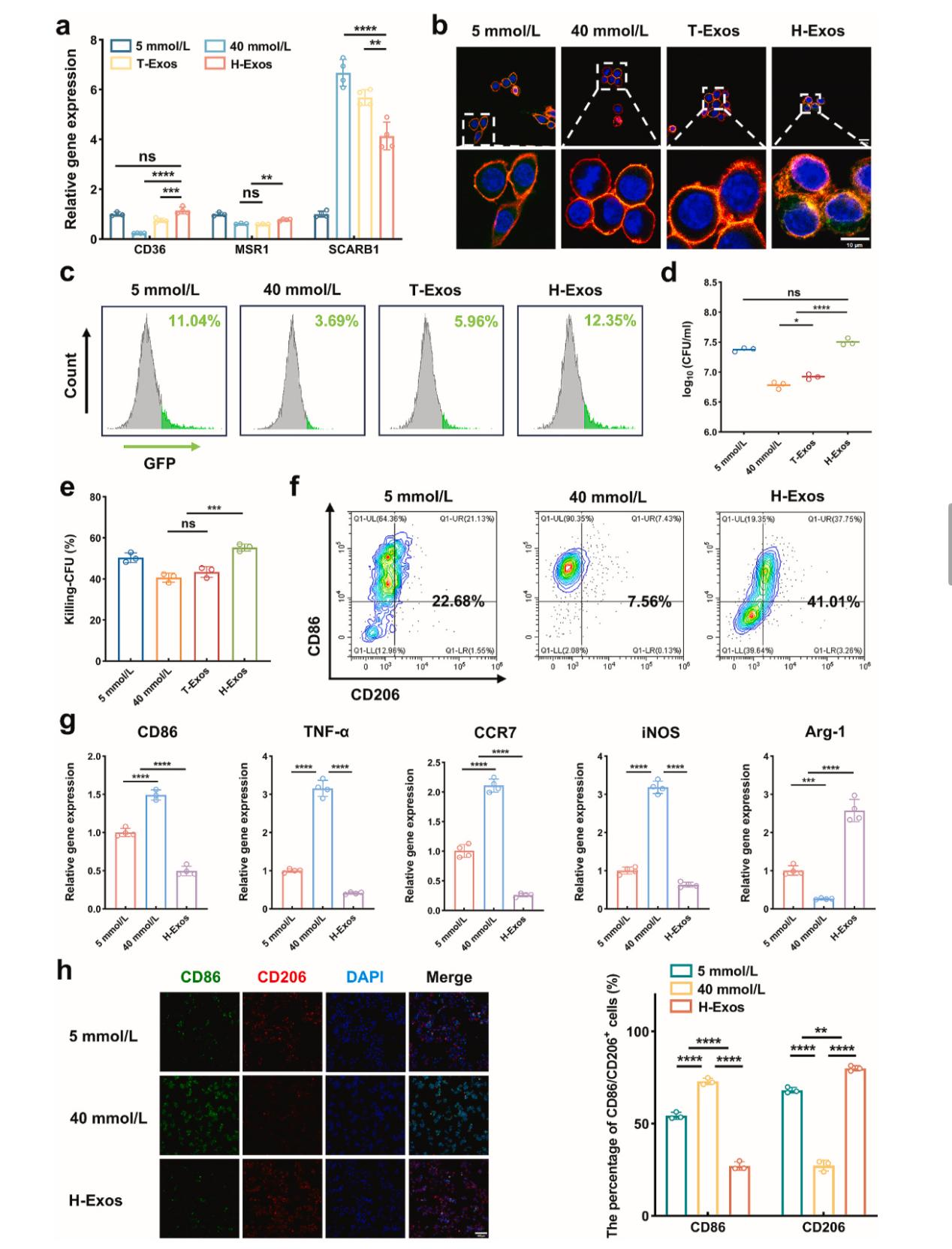
Figure 4. H-Exos增强巨噬细胞吞噬作用并驱动M2极化。
外泌体不仅是免疫调节剂,还是智能药物载体:
-
精准释药设计:装载万古霉素(V)和溶葡萄球菌酶(L),当遇到细菌分泌的 α- 溶血素时,外泌体膜会形成孔隙,快速释放药物。
-
内外双重绞杀:对细胞外细菌,1/3 最低抑菌浓度(minimun inhibitory concentration,MIC) 的 V+1/8 MIC 的 L 组合可在 24 小时内清除 99% 的 MRSA;对胞内细菌,该组合能将巨噬细胞内的细菌载量降低 90% 以上(Figure 5)。
-
生物膜克星:低浓度组合(1/8 MIC V+3/8 MIC L)可破坏生物膜结构,使死菌比例从 0.69% 飙升至 84.56%(Figure 6)。
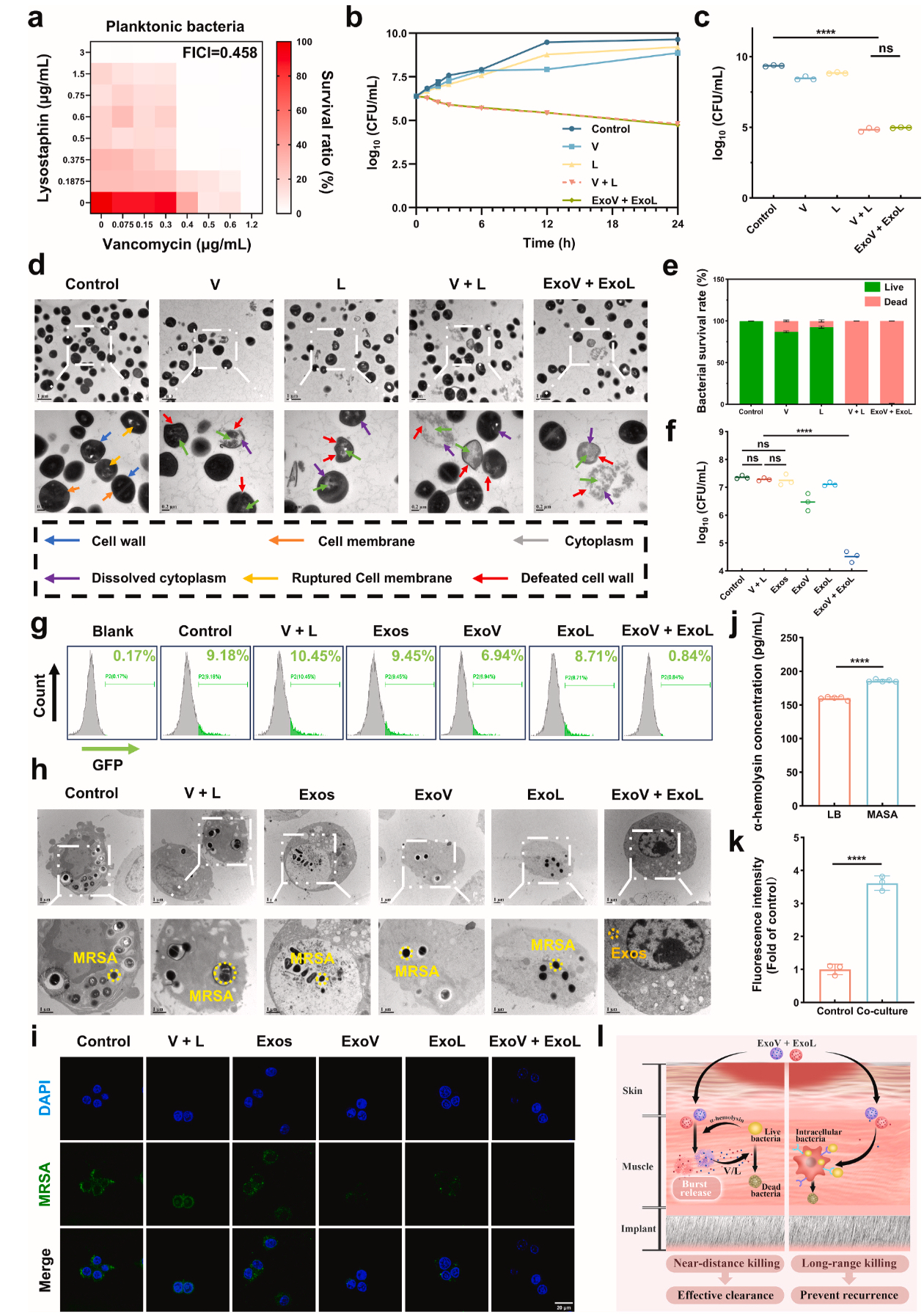
Figure 5. ExoV和ExoL协同作用对抗细胞外和细胞内细菌感染的功效和机制。
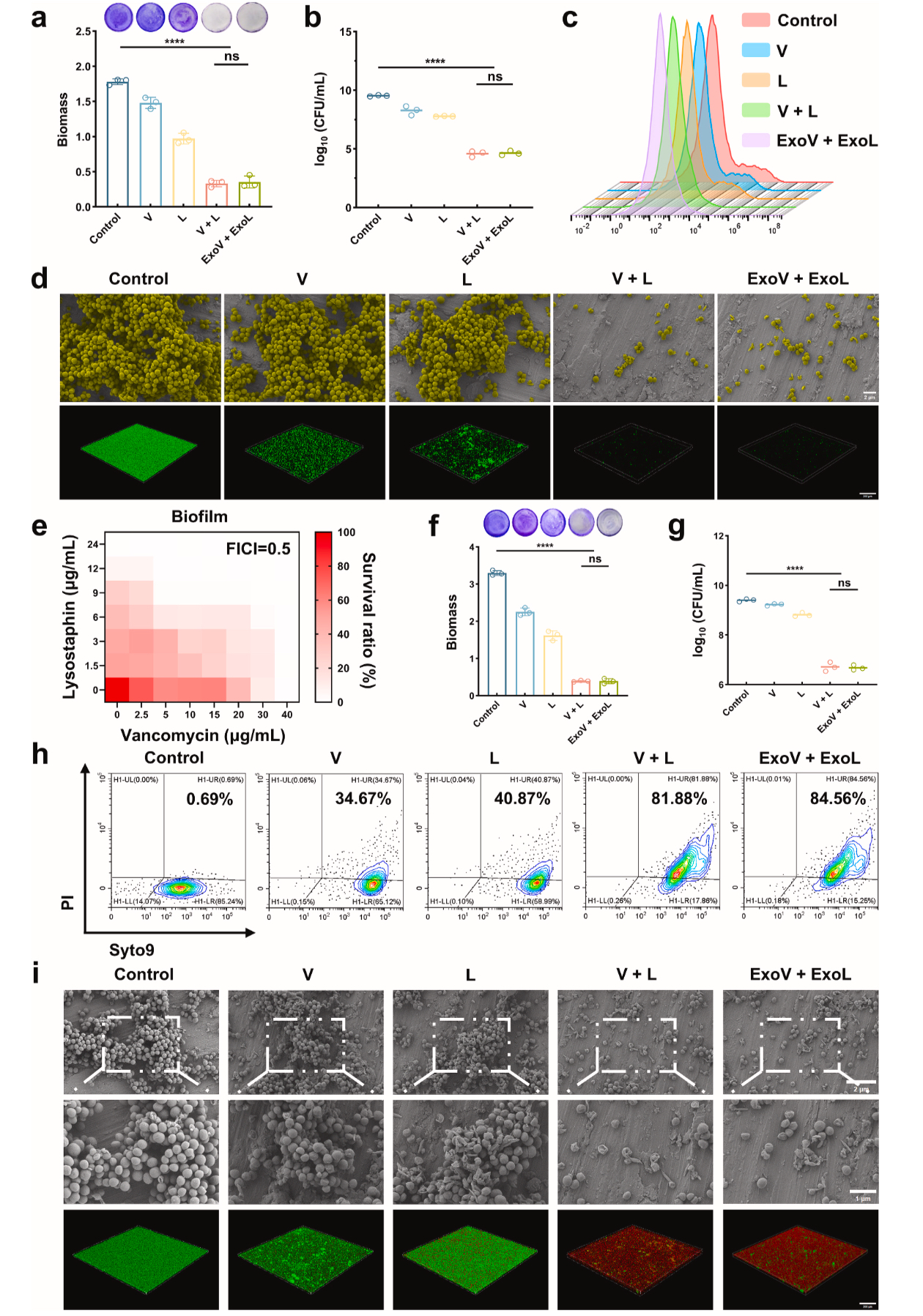
Figure 6. ExoV和ExoL对生物膜的协同抑制和破坏。
再生丝素蛋白(RSF)微针贴片:
可定制的“皮肤药房”
微针(MN)最近已经成为糖尿病伤口管理研究中的焦点,这是由于它们的高载药量、最小侵入性、强粘附性和易于应用,这共同增强了患者的舒适度和顺应性[10]。通过破坏皮肤屏障,MN能够将药物、蛋白质和纳米颗粒直接经皮递送到伤口床,显著提高渗透性和治疗效果[11-12]。与传统的水凝胶或贴剂相比,MN提供精确的持续药物释放,提高生物利用度,同时最大限度地减少全身副作用,使其非常适合局部治疗[13]。在各种生物材料中,再生丝素蛋白(RSF)是一种FDA批准的天然聚合物,具有出色的生物相容性和机械耐用性[14]。除了作为生物活性分子的保护基质外,RSF还可以实现有效的药物包封和控释,从而增强治疗剂在生物表面或体内的稳定性[15]。此外,甘油作为增塑剂的掺入调节了RSF的β-折叠形成,改善了MN的柔韧性并优化了药物释放动力学[16-18]。这些优点使基于RSF的MN成为糖尿病伤口护理中精确药物递送的理想平台。为解决外泌体直接注射易被清除的问题,团队开发了再生丝素蛋白(RSF)微针贴片(Figure 7):
-
微创精准递送:650μm 的锥形微针可穿透皮肤屏障,将药物直接送达伤口床。
-
按需释放调控:通过调节甘油含量(0-10%),可控制外泌体释放速率,10% 甘油组 6 天内有60% 的药物缓释。
-
定制生产:临床医生可根据感染情况实时混合外泌体和抗生素,现场制备贴片(fabrication@clinic)。
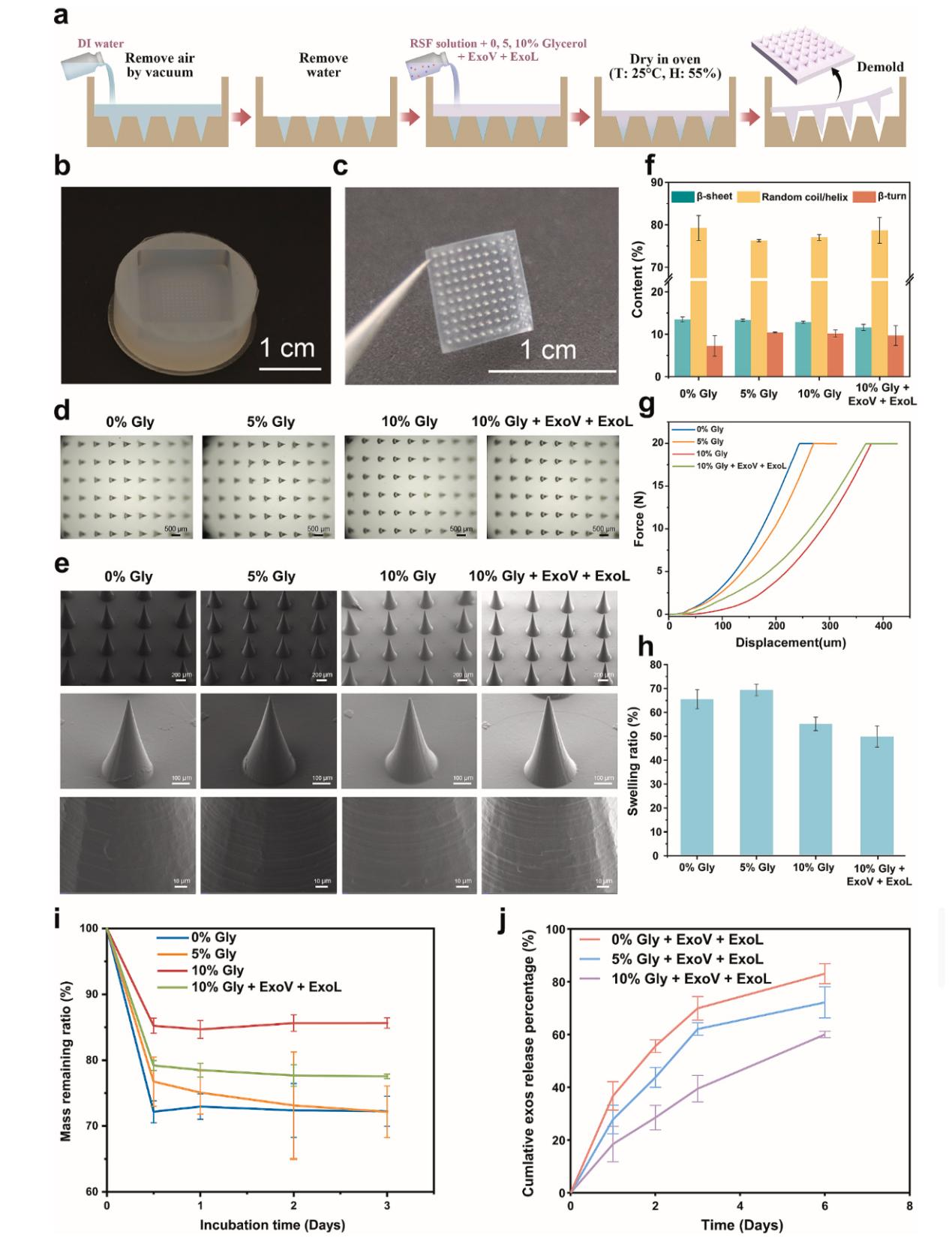
Figure 7. ExoV-ExoL@MN的制备和表征。
在糖尿病小鼠感染模型中,ExoV-ExoL@MN 展现出惊人疗效(Figure 8):
-
感染清除效率:术后 14 天,治疗组伤口细菌载量接近零,而对照组仍有大量细菌定植。
-
伤口愈合加速:治疗组伤口在 10 天内完成上皮化,对照组则持续红肿、溃疡。
-
免疫微环境重塑:免疫荧光显示,治疗组 M2 型巨噬细胞比例增多,促炎因子 TNF-α、IL-6 水平降低,胶原沉积更有序,组织修复质量显著提高(Figure 9)。
-
安全性高:该系统展现出良好的生物相容性,无论是细胞实验还是动物器官切片,均未观察到明显毒性。
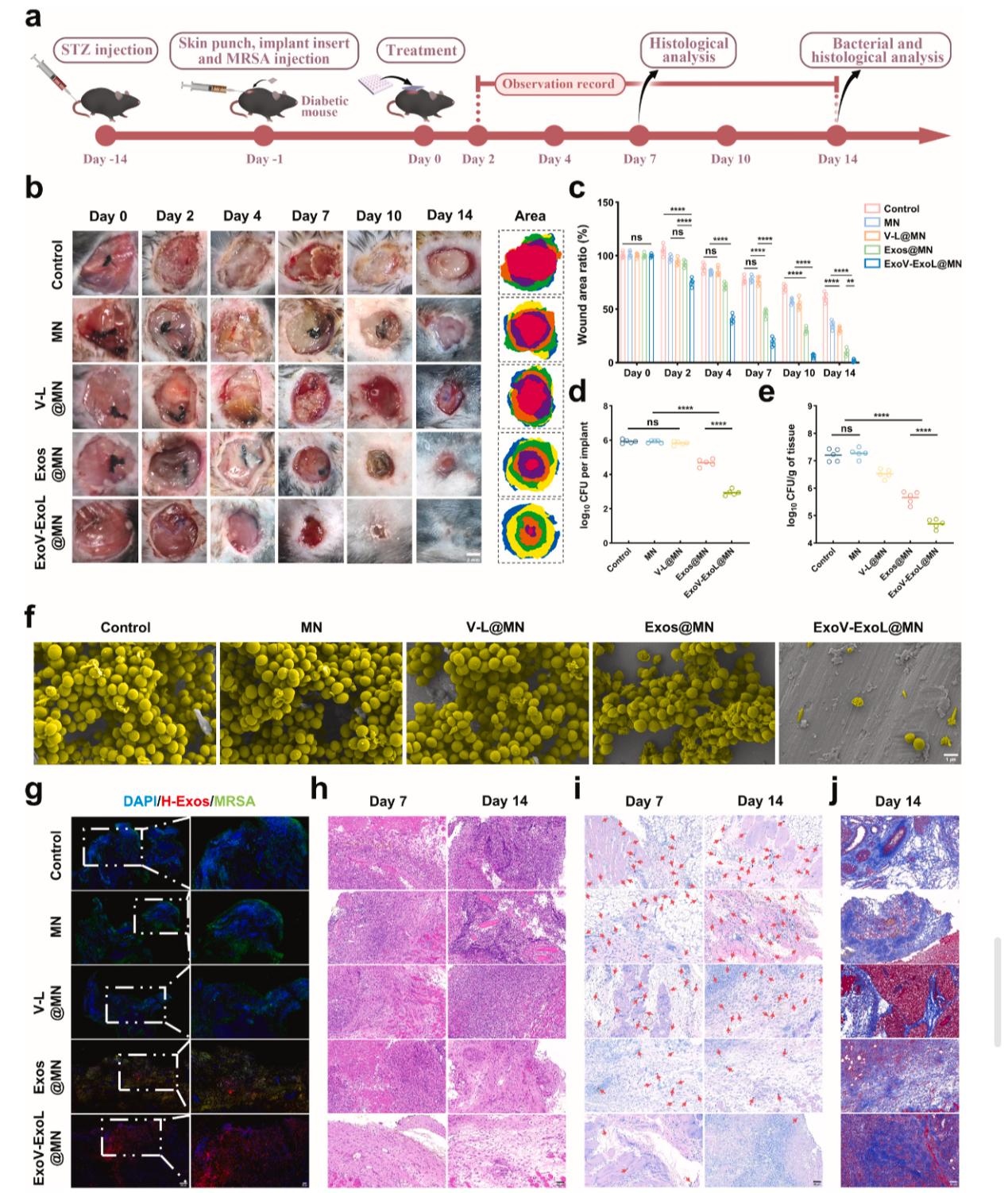
Figure 8. ExoV-ExoL@MN有效消除SSI诱导的PJI并促进体内糖尿病感染伤口的愈合。
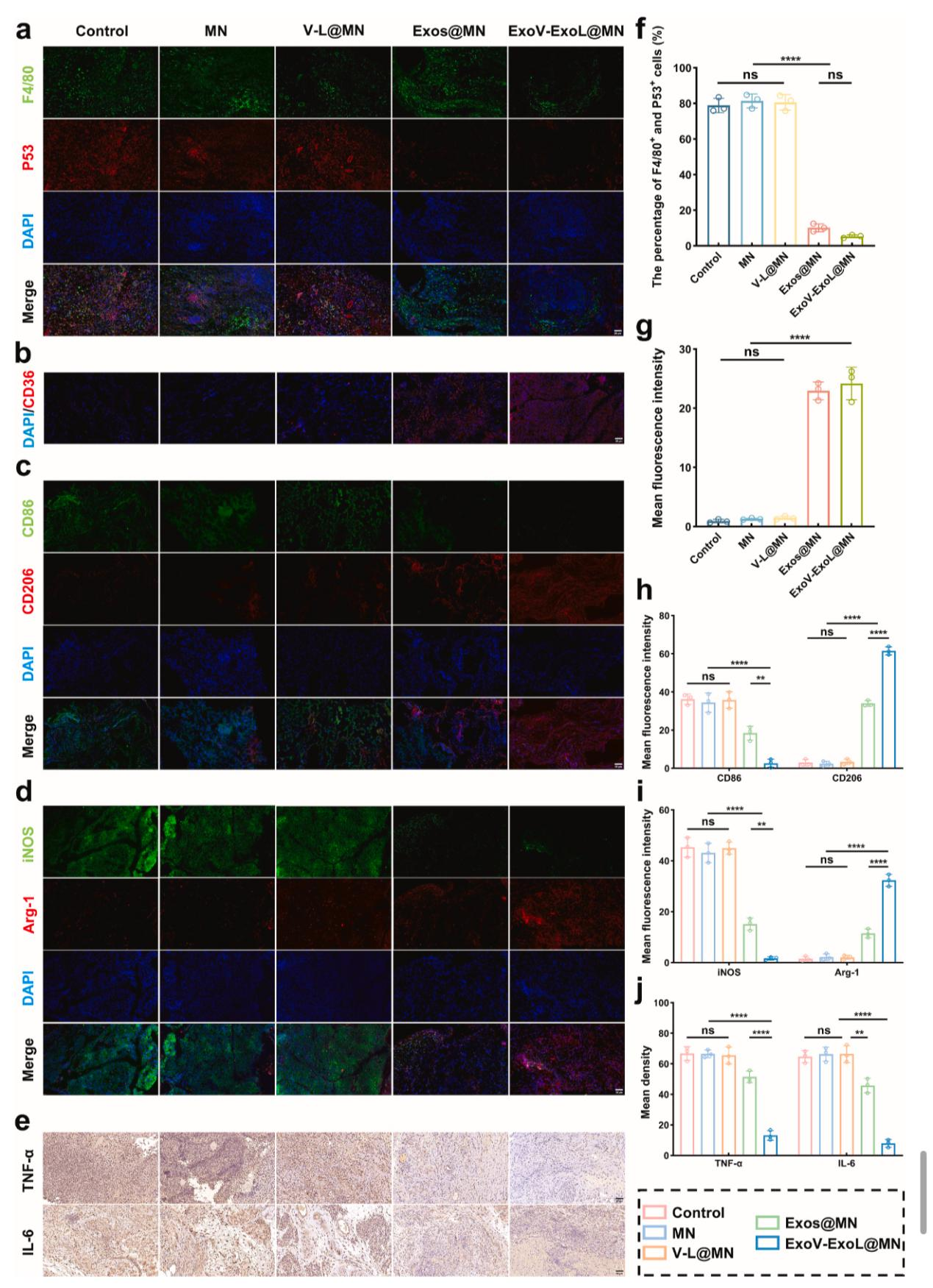
Figure 9. ExoV-ExoL@MN逆转糖尿病感染中的免疫抑制并促进M2巨噬细胞极化。
这项研究的创新之处在于「免疫 - 细菌」双靶点协同策略:外泌体负责逆转免疫衰老,恢复机体自身防御能力;微针贴片实现抗生素的精准释放,降低耐药风险。这种「标本兼治」的思路,为糖尿病感染防治提供了全新范式。该研究已通过细胞和动物实验验证安全性与有效性,且外泌体及丝素蛋白均为临床认可材料,转化潜力巨大。对糖尿病患者难治性感染的治疗具有重大的革命性潜力,尤其是关节置换术后感染高风险人群提供革命性治疗手段。团队还发现,H-Exos中的特异性miRNAs,它们可能是这些作用的关键介质。外泌体中的miR-370-3p和miR-432-5p是逆转衰老的关键分子(Figure 10),在细菌感染根除后,它们促进了糖尿病微环境中持续M1极化的巨噬细胞向M2表型的自然转变,从而实现抗炎和修复功能。为后续药物开发提供了靶点。
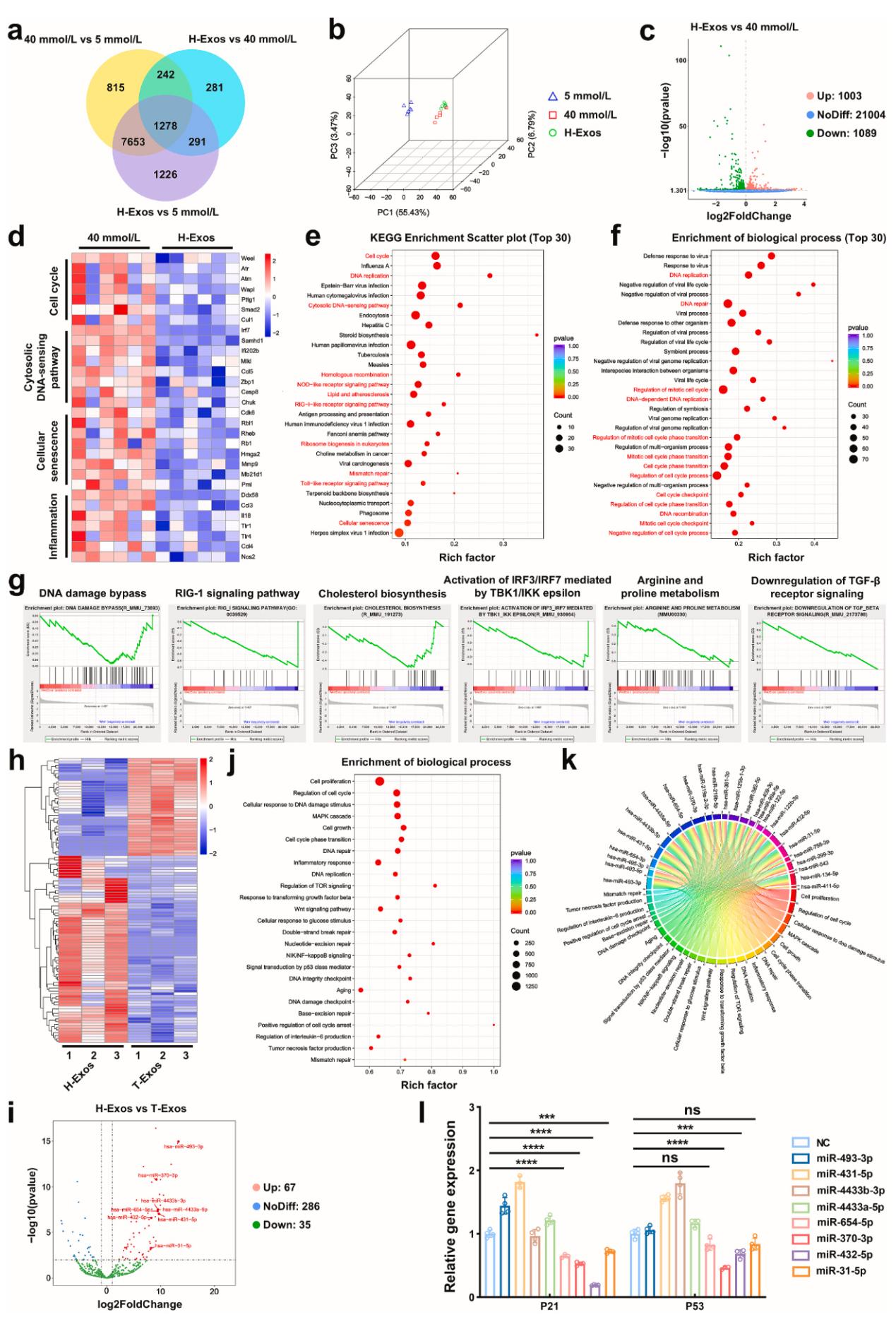
Figure 10. H-Exos在衰老巨噬细胞复壮中的内在机制和潜在效应物miRNAs
免疫与药物的“强强联合”,让糖尿病感染治疗迈入精准时代。未来,随着临床转化推进,这一技术有望成为对抗耐药菌感染、逆转免疫衰老的利器,为全球数亿糖尿病患者带来福音。
外泌体在糖尿病感染治疗中扮演着逆转巨噬细胞衰老、重塑免疫微环境及精准递送抗生素的关键角色,是整个治疗策略的核心组成部分。为了满足科研和临床的需求,加速外泌体的制备和生产,同腾新创开发了CEL-G®外泌体一站式制备平台(Figure 11)。CEL-G®系列产品主要包括CEL-G® Culture MSC无血清培养基、CEL-G® Culture Ad60固定床生物反应器、CEL-G® TFF Lab外泌体浓缩系统,GMP 兼容的生产和纯化方法,为行业提供自动化、封闭式、规模化的一站式生产解决方案。

Figure 11. 同腾新创CEL-G®外泌体一站式制备平台
上游生产:固定床生物反应器
实现低剪切力、高效、稳定的3D培养
CEL-G® Culture Ad60 系列固定床生物反应器可实现天然细胞外泌体及工程化外泌体的大规模生产。其独特的3D培养设计提供低剪切力环境,支持多种细胞的高密度培养及外泌体高效收获。全封闭自动化生产结合智能控制系统,精准优化培养条件,降低污染风险,确保细胞健康和外泌体稳定分泌。系统支持多批次连续收集,提高生产效率,并减少批次差异,保证外泌体质量均一,符合GMP标准。CEL-G® Culture Ad60 的2平米固定床生物反应器搭配CEL-G® Culture MSC无血清培养基已实现了1015量级的外泌体总产量。
下游提取:TFF Lab外泌体浓缩系统
实现高效富集
CEL-G® TFF Lab 系列外泌体浓缩系统可实现外泌体的分离纯化。该系统采用多级程序化设计,支持自动化完成澄清-浓缩-缓冲液置换-除菌多级纯化步骤,10L细胞培养上清可在1小时内完成全流程处理、操作高效便捷。用户可灵活调节收获体积,并通过人机交互界面实时监控参数,全程符合GMP规范。配备一次性封装耗材包,可快速完成高倍浓缩与定量收获,减少人工干预,降低操作误差。其独特的设计理念在一定程度上有效减少了滤膜堵塞现象,从而更好地保障了外泌体形态和功能的完整性,所收获的外泌体纯度高、活性好,符合外泌体鉴定标准,适用于规模化生产。
[1] B.H. Kapadia,R.A.贝格,J.A. Daley,J. Fritz,A. Bave,M.A. Mont,Perimprove joint infection,Lancet 387(2016)386-394, https://doi.org/10.1016/S0140-6736 (14)61798-0.
[2] TN Peel、MM Dowsey、JR Daffy、PA Stanley、PFM Choong、KL Buising,根据关节置换术现场的人工髋关节和膝关节感染风险因素,J. Hosp. Infect. 79(2011)129-133, https://doi.org/10.1016/j.jhin.2011.06.001.
[3] J. Mei, D. Xu, L. Wang, L. Kong, Q. Liu, Q. Li, X. Zhang, Z. Su, X. Hu, W. Zhu, M. Ye, J. Wang, C. Zhu, Biofilm microenvironment-responsive self-assembly nanoreactors for all-stage biofilm associated infection through bacterial cuproptosis-like death and macrophage re-rousing, Adv. Mater. 35 (2023) 2303432, https://doi.org/ 10.1002/adma.202303432.
[4] W. Zhao, L. Ma, C. Cai, X. Gong, Caffeine inhibits NLRP3 inflammasome activation by suppressing MAPK/NF-κB and A2aR signaling in LPS-induced THP-1 macrophages, Int. J. Biol. Sci. 15 (2019) 1571–1581, https://doi.org/10.7150/ ijbs.34211.
[5] C. Xue, K. Chen, Z. Gao, T. Bao, L. Dong, L. Zhao, X. Tong, X. Li, Common mechanisms underlying diabetic vascular complications: focus on the interaction of metabolic disorders, immuno-inflammation, and endothelial dysfunction, J. Cell.
[6] J. Zou, W. Yang, W. Cui, C. Li, C. Ma, X. Ji, J. Hong, Z. Qu, J. Chen, A. Liu, H. Wu, Therapeutic potential and mechanisms of mesenchymal stem cell-derived exosomes as bioactive materials in tendon–bone healing, J. Nanobiotechnol. 21 (2023) 14, https://doi.org/10.1186/s12951-023-01778-6.
[7] A. Shapouri-Moghaddam, S. Mohammadian, H. Vazini, M. Taghadosi, S.- A. Esmaeili, F. Mardani, B. Seifi, A. Mohammadi, J.T. Afshari, A. Sahebkar, Macrophage plasticity, polarization, and function in health and disease, J. Cell. Physiol. 233 (2018) 6425–6440, https://doi.org/10.1002/jcp.26429.
[8] C.M. Liao, T. Luo, J. von der Ohe, B. de Juan Mora, R. Schmitt, R. Hass, Human MSC-derived exosomes reduce cellular senescence in renal epithelial cells, Int. J. Mol. Sci. 22 (2021) 13562, https://doi.org/10.3390/ijms222413562.
[9] M. Oh, J. Lee, Y.J. Kim, W.J. Rhee, J.H. Park, Exosomes derived from human induced pluripotent stem cells ameliorate the aging of skin fibroblasts, Int. J. Mol. Sci. 19 (2018) 1715, https://doi.org/10.3390/ijms19061715.
[10] Z. Guo, H. Liu, Z. Shi, L. Lin, Y. Li, M. Wang, G. Pan, Y. Lei, L. Xue, Responsive hydrogel-based microneedle dressing for diabetic wound healing, J. Mater. Chem. B 10 (2022) 3501–3511, https://doi.org/10.1039/d2tb00126h.
[11] J. Xu, R. Danehy, H. Cai, Z. Ao, M. Pu, A. Nusawardhana, D. Rowe-Magnus, F. Guo, Microneedle patch-mediated treatment of bacterial biofilms, ACS Appl. Mater. Interfaces 11 (2019) 14640–14646, https://doi.org/10.1021/acsami.9b02578.
[12] S. Yao, Y. Wang, J. Chi, Y. Yu, Y. Zhao, Y. Luo, Y. Wang, Porous MOF microneedle array patch with photothermal responsive nitric oxide delivery for wound healing, Adv. Sci. (Weinh) 9 (2022) e2103449, https://doi.org/10.1002/advs.202103449.
[13] G. Aj, C. As, D. Rf, M. Mc, G. Tm, M. A, Microneedle-based delivery: an overview of current applications and trends, Pharmaceutics 12 (2020), https://doi.org/ 10.3390/pharmaceutics 12060569.
[14] B. Kundu, R. Rajkhowa, S.C. Kundu, X. Wang, Silk fibroin biomaterials for tissue regenerations, Adv. Drug Deliv. Rev. 65 (2013) 457–470, https://doi.org/ 10.1016/j.addr.2012.09.043.
[15] H. Zhang, L.-L. Li, F.-Y. Dai, H.-H. Zhang, B. Ni, W. Zhou, X. Yang, Y.-Z. Wu, Preparation and characterization of silk fibroin as a biomaterial with potential for drug delivery, J. Transl. Med. 10 (2012) 117, https://doi.org/10.1186/1479-5876- 10-117.
[16] J.K. Sahoo, O. Hasturk, T. Falcucci, D.L. Kaplan, Silk chemistry and biomedical material designs, Nat. Rev. Chem. 7 (2023) 302–318, https://doi.org/10.1038/ s41570-023-00486-x.
[17] Q. Bian, Y.-H. Xu, X.-L. Ma, J.-Y. Hu, Y.-T. Gu, R.-X. Wang, A.-R. Yuan, W.-T. Hu, L.-L. Huang, N. Li, J.-Q. Gao, Differential dual-release bilayer microneedles loaded with aluminum adjuvants as a safe and effective vaccine platform, Adv. Funct. 32 (2022) 2201952, https://doi.org/10.1002/adfm.202201952.
[18] H. Lyu, Z. Sun, Y. Liu, X. Yu, C. Guo, Processing-structure-properties relationships of glycerol-plasticized silk films, Molecules 27 (2022) 1339, https://doi.org/10.3390/molecules 27041339.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
