-
新闻
专注「小而精」:同腾新创如何用CEL-G® TFF Scientific撬动外泌体大市场?
发布日期:2025-09-24
外泌体,这个直径仅30-150纳米的细胞外囊泡,已成为生命科学领域最热门的研究对象之一。据全球市场洞察报告显示,外泌体市场规模预计到2026年将超过5亿美元,年复合增长率高达19.3%。然而,在这片繁荣背后,一个长期被忽视的瓶颈制约着整个领域的发展:实验室级别的高质量、标准化外泌体制备。传统的超速离心方法不仅耗时长达10小时以上,而且需要大量人工操作,导致批次间差异大,回收率低且易损害外泌体完整性。这些问题直接影响了研究数据的可靠性和可重复性。
在生命科学仪器多被国际巨头垄断的赛道上,中国创新企业同腾新创精准洞察实验室场景需求,CEL-G® TFF Scientific 外泌体浓缩处理系统—— 一款以 “自动化、一体化、实验室级” 为核心的突破性设备,将工业级切向流过滤(TFF)技术微型化、智能化改造,为高质量外泌体制备提供 “小而精” 的解决方案。
纵观外泌体研究领域,制备环节存在三大挑战:效率低下、标准化不足和可扩展性有限。大多数实验室仍依赖超速离心这一"金标准",但该方法对操作人员技术要求高,且产量有限,人工操作批间次差异大,无法满足大规模筛选需求。

图1.传统UC离心提取外泌体
"外泌体研究领域最大的挑战之一是缺乏可重复且高效的方法来分离高质量的外泌体,"国际细胞外囊泡学会(ISEV)在其技术指南中指出[1]。聚合物沉淀法虽然操作简单,但会引入外泌体聚合剂污染,影响下游实验结果的准确性。尺寸排阻色谱法虽然纯度较高,但处理量有限,稀释倍数大,需要后续浓缩步骤。这些问题在基础研究中尚可勉强应对,但当研究进入转化医学阶段,需要大量高质量外泌体时,传统方法的局限性就变得尤为突出。特别是在工程化外泌体领域,传统的制备方法已完全无法满足产业化需求。
2、小而精的战略定位
同腾新创的差异化破局
在同质化竞争日益激烈的科学仪器市场,同腾新创专注于研发专业的外泌体制备设备,开发上游到下游的外泌体生产一体化解决方案,上游从CEL-G®Ad60到CEL-G®Ad600,下游从CEL-G®TFF Scientific到CEL-G® TFF Lab,上下游设备均实现了规模逐级放大。
同腾新创新发布的CEL-G® TFF Scientific外泌体浓缩处理系统的设计理念围绕三个核心关键词:自动化、一体化、实验室级。与传统工业型TFF系统不同,同腾新创的产品专门为实验室环境设计,体积小巧,操作简单,工艺时间短。该系统由控制器主机、人机交互界面和一次性封装耗材包组成,可实现自动运行清洗-浓缩-收获多级程序。

图2. CEL-G®TFF Scientific 外泌体浓缩系统
CEL-G® TFF Scientific 外泌体浓缩系统采用切向流动态过滤原理,液体的沿膜表面切向流动,通过分子截留选择性分离外泌体(30-150nm),避免传统超速离心法的高剪切力损伤,确保外泌体囊泡结构和生物活性成分(如 RNA、蛋白质)的完整性。
"切向流过滤技术(TFF)是最有前景的外泌体分离技术之一,它既能保持外泌体的生物活性,又能实现较高的回收率,"美国西北大学外泌体研究专家Zhang等在论文中指出[2]。同腾新创的创新在于将工业界成熟的TFF技术进行小规模一体化、智能化改造,使其适应实验室场景的需求。系统可实时监测、定量收获、高倍浓缩外泌体。
一项发表于Journal of Extracellular Vesicles的研究证实,TFF技术相比超速离心,能获得更高的外泌体回收率和更完整的囊泡结构,更好地保持外泌体的生物活性[3]。
表1. CEL-G® TFF Scientific对比传统超速离心法(UC)提取外泌体的优势总结
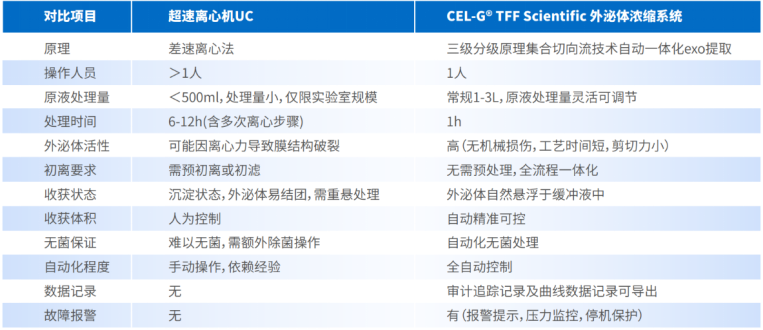
3、技术突破
微型化背后的创新哲学
CEL-G® TFF Scientific外泌体浓缩处理系统的技术优势体现在多个方面,解决了外泌体研究中的诸多痛点。
1-3L样本可以在1h小时内完成浓缩,显著缩短实验周期,尤其适用于对时间敏感的临床样本或药物载体开发,工艺时间短,外泌体受剪切力影响小,保持高活性。整个处理过程静音、安全、顺畅,收获的外泌体符合相关鉴定标准。
通过集成先进的传感器、控制器和数据处理软件,系统能够实时监测过滤过程中的关键参数,根据预设条件自动调整操作参数,确保过程稳定性和可靠性,减少人工干预和操作误差。
具有广泛样本适用性,兼容多种来源细胞培养上清、微生物发酵液、植物提取液等外泌体样本,支持小规模或定制化生产的全流程需求。
灵活模块化设计,设备配备可更换耗材包,用户可根据工艺流程灵活选用合适耗材包,并能够满足一定程度的耗材包按需定制,实现个性化实验设计。
相比超速离心耗电量和进口设备及耗材,国产自研的CEL-G® TFF Scientific 外泌体浓缩系统性价比更高,核心浓缩耗材可重复使用,一次性无菌膜包安装方便,单次处理成本降低50%以上。
实时监控运行压力和外泌体提取体积量,确保过程可控。支持实验参数(如样品体积量、处理时间、压力数值)自动记录和导出,为GMP或ISO标准下的质量管控提供完整数据链。
科研实验室
外泌体蛋白质组学/转录组学样本前处理。
外泌体载药系统开发中的载体浓缩与缓冲液置换。
临床研究
小批量临床研究用异体干细胞外泌体样本提取。
生物制药企业
少量患者自体干细胞外泌体的快速富集。
小规模外泌体药物中间体的质量控制与工艺优化。
康养、美容保健行业
高端客户定制化外泌体生产。
4、应用案例:
工程化外泌体制备
工程化外泌体作为药物递送系统正在成为生物医药领域的新热点。多项研究表明,基于293细胞的工程化外泌体在靶向给药、基因治疗和疫苗开发中展现出巨大潜力[4-7]。全球外泌体市场报告显示[8],药物递送系统是外泌体应用中增长较快的领域,多家制药巨头已布局外泌体为基础的递送平台技术,这将为专注于外泌体制备技术的公司带来持续增长机会。在工程化外泌体工艺开发过程中,往往需要快速提取上游培养的少量样品供QC检测和功能鉴定,CEL-G® TFF Scientific系统因具备原液上机量灵活、上清无需预处理、澄清/浓缩/置换/除菌多步骤集成化自动化操作等优势,可在工程化外泌体工艺开发中助力样品高效纯化,以下是HEK 293T细胞外泌体的鉴定结果:
经过NTA检测HEK 293T细胞原液上清颗粒浓度为1.9E+11 Particles/mL,浓缩后外泌体颗粒浓度为1.8E+12 Particles/mL,粒径在30-150nm范围内存在峰值。
表2. HEK 293T细胞来源外泌体NTA、BCA检测数据
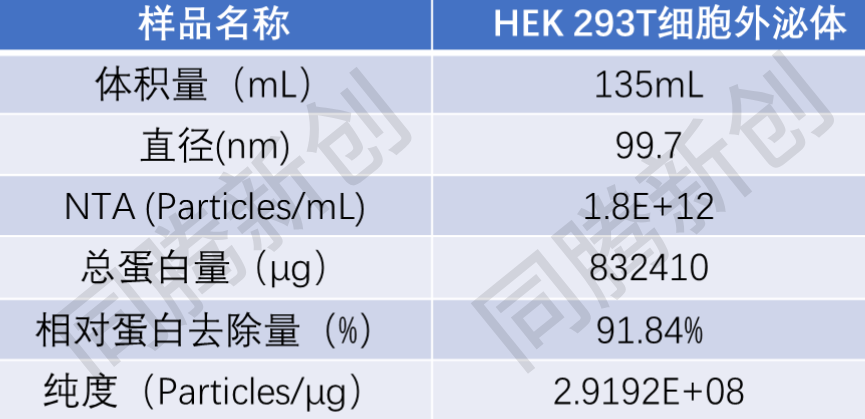
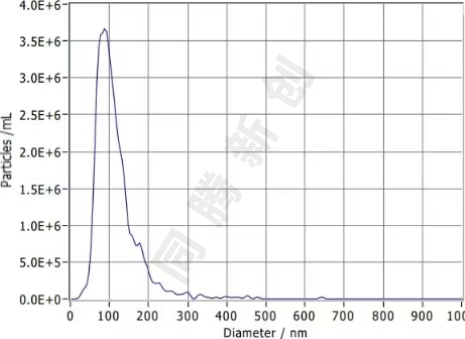
图3. HEK 293T细胞来源外泌体粒径分布图
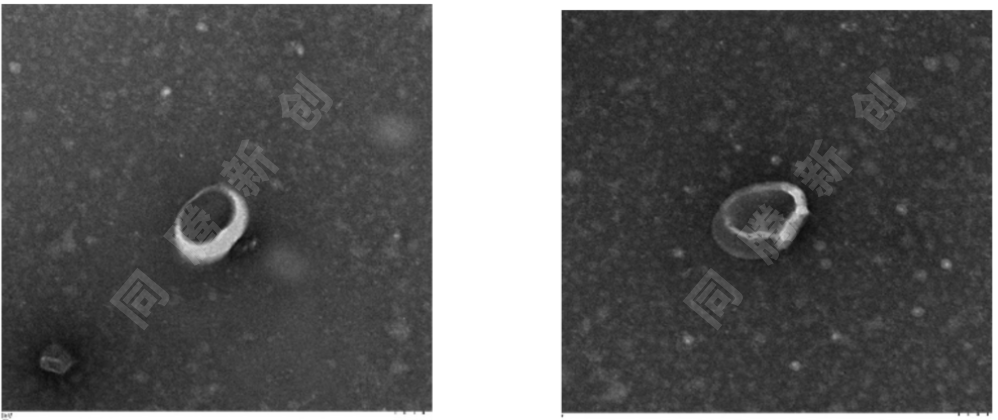
图4. HEK 293T细胞来源外泌体TEM电镜图
通过以上外泌体鉴定结果表明CEL-G®TFF Scientific外泌体浓缩系统能够从HEK 293T细胞培养上清中提取高浓度高质量工程化外泌体,相比超速离心等传统外泌体提取方式,TFF Scientific外泌体浓缩系统显著提高了外泌体提取效率,全流程自动化处理的同时保持了外泌体的完整性和生物学活性。
5、战略布局
以小博大的市场智慧
同腾新创的市场策略体现了深刻的行业洞察:从实验室场景切入,建立技术标准和用户习惯,最终向上游和下游扩展。科学研究领域是新技术的验证场和扩散源。外泌体应用领域的多样性也为专业化设备提供了广阔的市场空间。从疾病生物标志物发现到药物递送系统开发,从干细胞治疗到肿瘤免疫治疗,每个应用领域都对高体外泌体制备有强烈需求。

图4. 同腾新创工艺实验室
从癌症早筛到神经退行性疾病研究,从疫苗开发到再生医学,这台"小而精"的设备正在成为众多重大科学突破背后的无名英雄。同腾新创的探索与实践,赋予了“国产自研”更深层的含义:真正的突破,始于对用户需求的深刻洞察。我们坚信,这款“小而精”的自动化外泌体浓缩系统,绝非实验室的锦上添花,而是实现科研与转化“精准、高效、可靠”的不可或缺基石。 同腾新创,愿以这份“不可或缺”的力量,与您携手,共同解锁外泌体的更多可能!
[1] Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 2018;7(1):1535750.
[2] Zhang Y, Bi J, Huang J, Tang Y, Du S, Li P. Exosome: A Review of Its Classification, Isolation Techniques, Storage, Diagnostic and Targeted Therapy Applications. Int J Nanomedicine. 2020;15:6917-6934.
[3] Lobb RJ, Becker M, Wen SW, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma. J Extracell Vesicles. 2015;4:27031.
[4] Watson DC, Bayik D, Srivatsan A, et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 2016;105:195-205.
[5] Li P, Kaslan M, Lee SH, et al. Progress in exosome isolation techniques. Theranostics. 2017;7(3):789-804.
[6] Li Y, Zhao R, Cheng K, et al. Exosomes as a novel delivery system for application in gene therapy. Bioactive Materials. 2021;6(5):1332-1344.
[7] Li Z, Zhou X, Gao X, et al. Engineering extracellular vesicles for drug delivery and therapeutic applications. Advanced Drug Delivery Reviews. 2021;174:53-78.
[8] Global Exosome Market Report 2022-2026: Market size, trends, and forecast analysis. Research and Markets, 2022.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
