-
新闻
案例应用丨临床规模外泌体质量研究及同腾CEL-G®外泌体平台实践
发布日期:2025-07-18
细胞外囊泡(EVs)作为干细胞衍生的“无细胞疗法”,在临床应用中已展现出巨大潜力。但要实现临床应用,“质量控制”是关键——如何确保每一批次的EVs都符合安全、有效、稳定的标准?今天带大家看一项“临床规模细胞外囊泡质量研究”的硬核案例!

该研究是关于“临床规模的MSC衍生细胞外囊泡增强啮齿动物和非人类灵长类动物中风后的神经可塑性”研究。EVs的内部载荷了人类线粒体DNA,数据显示EVs产物具有良好的批次间一致性。实验确定了在小鼠中风模型中静脉注射囊泡的合适剂量和频率,连续5天静脉注射6×105个EVs后,观察到最小的梗死体积和运动功能的改善。生物分布研究表明,EVs迅速分布到全身器官,并且相对特异性地分布到梗死脑区。随后,在狨猴中风模型中验证了EVs的有效性。结果显示,连续5天静脉注射等效剂量(3.5×106个EVs)显著改善了运动功能和扩散MRI上的解剖连接性,并显著减少了梗死体积。蛋白质组学分析表明,EVs治疗促进了神经发生、突触组织和血管发育。总之,该研究首次证明了临床规模的EVs产品是在非人类灵长类动物中风模型中安全并显著增强功能恢复和神经可塑性,为人类中风提供了一种有希望的治疗方法【1】。
研究团队采用3D微球培养板无血清培养基培养沃顿胶间充质干细胞(WJ-MSCs),收集的1.8L培养上清通过离心和0.22μm过滤后采用切向流过滤(TFF)技术分离出囊泡,置换到PBS缓冲液后再进行0.22μm过滤,于-80℃保存。这种3D培养工艺不仅提升了产量,更通过标准化流程为后续质量控制打下基础。
为验证EVs的“临床级”品质,研究采用电镜、纳米颗粒跟踪分析、纳米流式细胞术、质谱分析蛋白质组学和脂质组学以及RNA测序等技术对这些囊泡进行了表征,从形态、功能到安全性进行了全链条检测,结果全达标!
电镜验证:透射电镜(TEM)和冷冻电镜(Cryo-EM)显示,EVs呈典型的“圆形”结构(图1),形态均一。

图1、通过透射电子显微镜(TEM)(左图)和冷冻电镜(右图)获取EVs的电子显微镜图像
粒径分布:纳米颗粒追踪分析(NTA)显示,外泌体平均粒径158.17±3.75 nm,模式粒径147.83±6.24 nm(图2),符合EVs的纳米级特征。
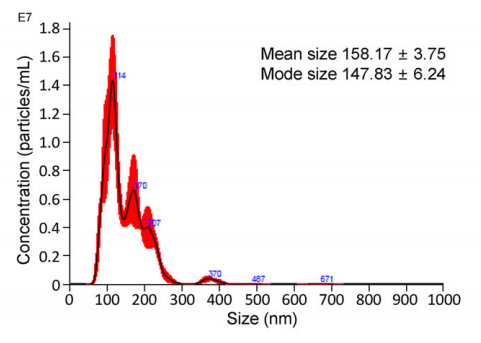
图2、使用NanoSight技术获得的EVs大小分布图
通过纳米流式细胞术(nanoFCM)检测:用膜特异性染料CMG标记后,94.9%的颗粒被染色;加入去垢剂Triton X-100裂解后,97.9%的颗粒被破坏,这说明95%以上的颗粒是真正的EVs(图3),杂质极少!
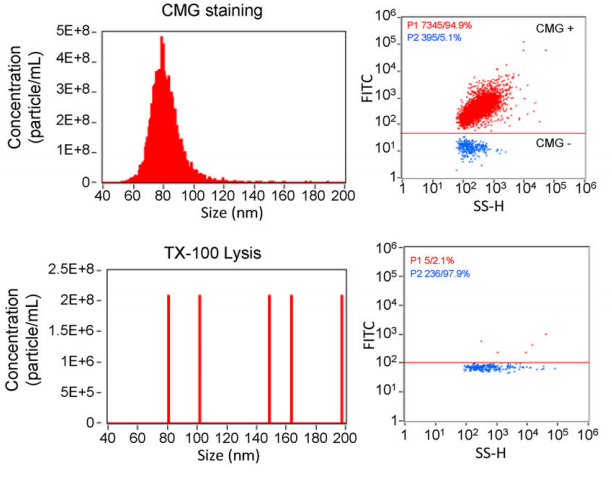
图3、使用膜特异性CMG染料标记的EVs,在TX-100处理前后,通过纳米颗粒流式细胞术(nFCM)进行了分析。CMG标记的EVs的代表性点图和粒径分布图(上图),以及TX-100处理后的结果(下图)。
EVs表面需携带特定标志物以证明“出身”。研究用多重磁珠流式分析(MACSPlex)检测发现:
MSC来源标记(CD29、CD44、CD105)阳性;EVs核心标记(CD9、CD63、CD81)阳性(图4),双重验证了MSC-EVs的“正宗身份”。
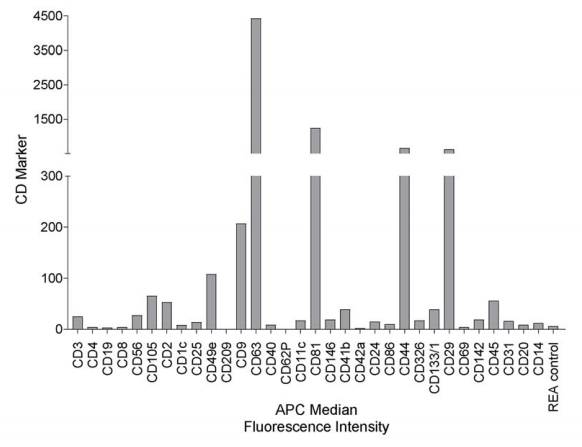
图4、使用多路珠基流式细胞术对EVs 表面标志物进行表达谱分析。显示了CD9/CD63/CD81 -APC检测后的EV表面标志物组成。
工艺杂质:培养基中的庆大霉素、牛血清白蛋白(BSA)未检出(图5);
细胞成分残留:内质网(钙连蛋白)、细胞核(组蛋白)、高尔基体(GM130)、线粒体(细胞色素C)等细胞器标志物均未检出(图5);
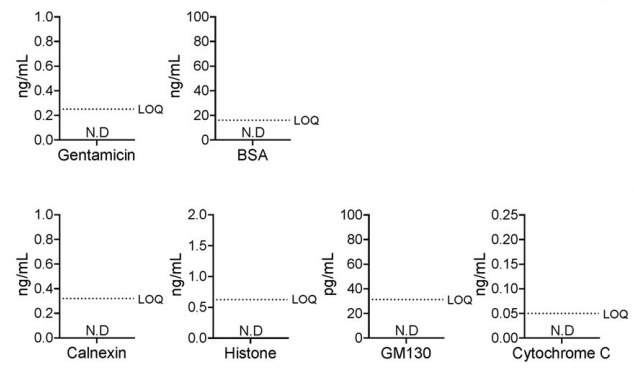
图5、评估EVs中存在的杂质。使用ELISA试剂盒分析了工艺相关性杂质(上图),包括庆大霉素和牛血清白蛋白(BSA)。通过ELISA试剂盒检查了细胞器标志物,如钙连蛋白(内质网蛋白)、组蛋白(核蛋白)、GM130(高尔基体蛋白)和细胞色素C(线粒体蛋白)(下图)。
注射安全性:pH 7.2(接近生理值)、渗透压305 mmol/kg(符合注射标准),且无菌、无支原体、无外源性病毒、内毒素小于1 EU/ml(图6)。
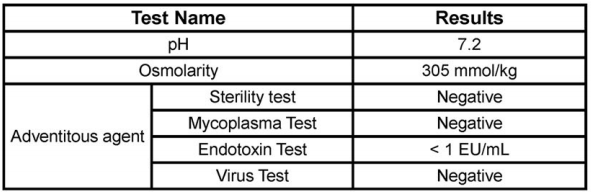
图6、EVs溶液的pH、渗透压、无菌、支原体、外源性病毒、内毒素检测结果
EVs的“疗效”依赖于其携带的蛋白质、RNA、脂质等货物种类。研究通过蛋白质组学、小RNA测序、脂质组学深度解析:
蛋白质:5452种蛋白,富集于“神经元投射发育”“血管生成”等功能(图7-A);
miRNA:416种miRNA,涉及神经发生(65种)、血管生成(153种)等(图7-B);
脂质:磷脂占比72.6%(包括PC、PS、SM等),胆固醇酯24.0%(图7-C)。
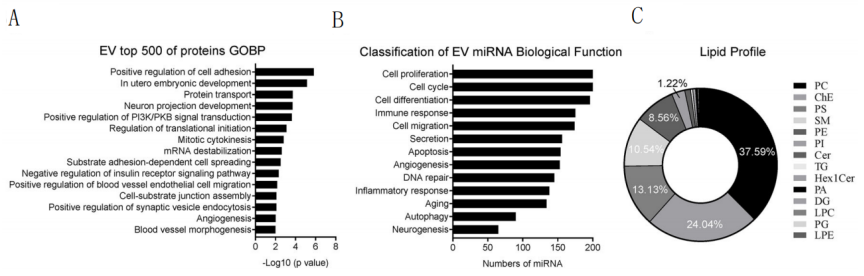
图7、EVs全面多组学分析
更重要的是,三批次EVs的多组学数据一致性>80%,证明生产工艺稳定,为临床应用提供了“可重复”的质量保障。
总结:从“合格”到“可靠”的临床之路
这项研究不仅展示了临床规模EVs的全流程质量控制体系(从生产到表征),更通过多维度检测证明了其“安全、有效、稳定”的特性。对于EVs疗法而言,这样的“质量档案”是从实验室走向临床的“通行证”——只有每一步都严格把关,才能让创新疗法真正惠及患者!
同腾新创自主研发的CEL-G®系列产品----“CEL-G® Culture MSC 无血清培养基”、“CEL-G® Culture Ad60固定床生物反应器”、“CEL-G® TFF Lab外泌体浓缩系统”,为EVs临床应用规模化生产提供一站式解决方案(图8)。该平台采用创新的3D固定化培养技术,通过低剪切力环境支持高密度细胞培养,并实现细胞培养与外泌体浓缩的全程自动化操作,展现了其在规模化生产中的高效性和稳定性。

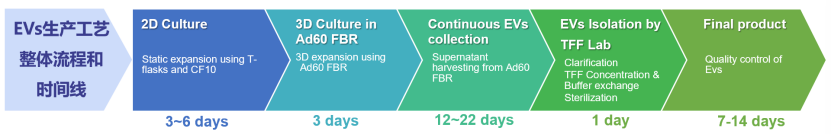
图8、同腾新创CEL-G®外泌体一站式制备平台及工艺流程
脐带间充质干细胞的3D培养和外泌体收获
脐带间充质干细胞使用同腾新创CEL-G® Culture Ad60固定床生物反应器进行3D培养(图9),可实现多批次连续收获,高效产出EVs。

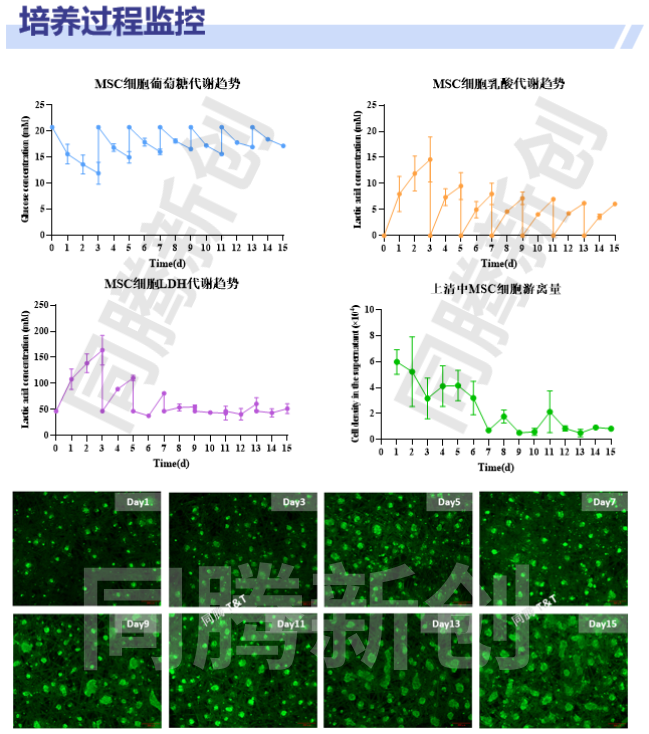
图9、脐带间充质干细胞3D培养工艺概述、工艺流程及培养过程监控
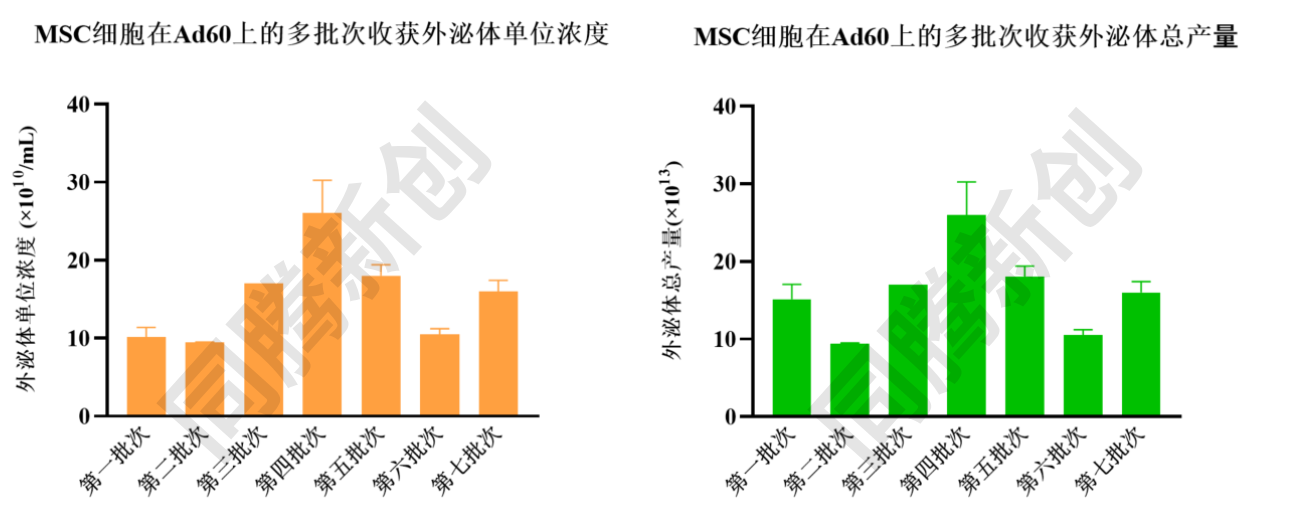
图10、脐带间充质干细胞3D培养连续收获EVs单位浓度及总产量
3D培养上清中外泌体浓缩提取
脐带间充质干细胞3D培养上清收获液,使用同腾新创CEL-G® TFF Lab外泌体浓缩系统,可实现EVs高效浓缩提取(图11)。

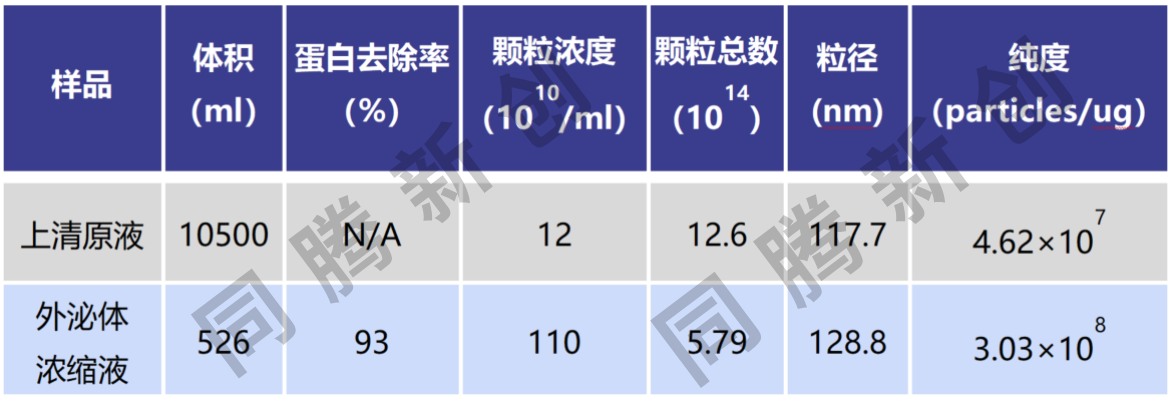
图11、CEL-G® TFF Lab外泌体提取工艺(上图)、外泌体浓缩液检测数据(下图)
3D-MSC-EVs质量表征
脐带间充质干细胞3D培养收获浓缩提取的EVs,其电镜形态、粒径分布、表面标志物、注射安全性检测,均符合EVs的质量要求(图12)。
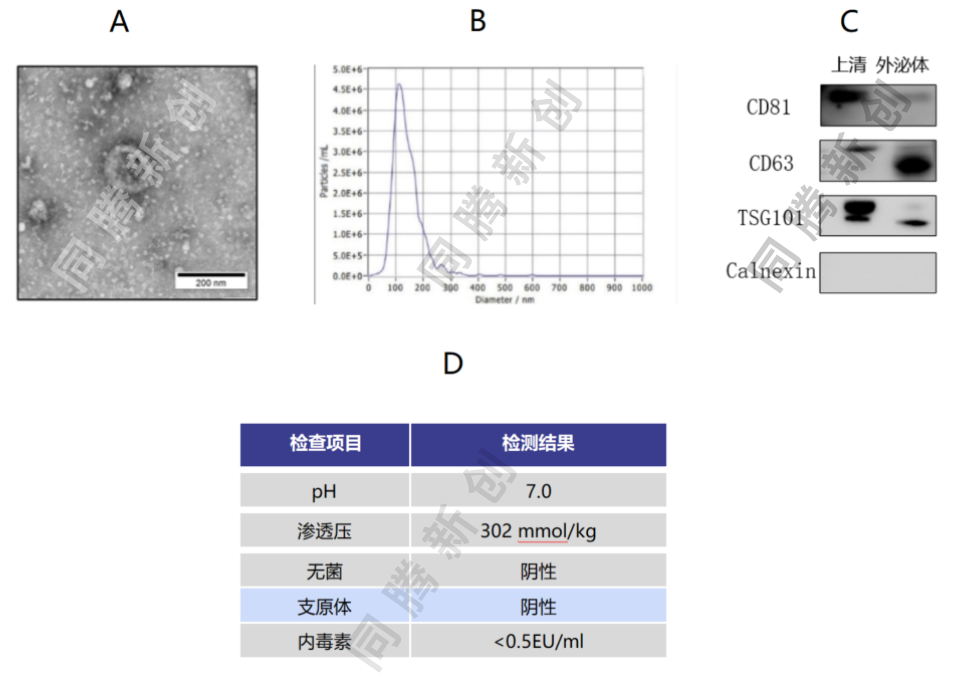
图12、A.电镜,B. NTA, C. WB,D. 实验室检查
EVs作为下一代无细胞疗法的核心载体,其临床转化的关键在于标准化、规模化的质量控制体系。同腾新创CEL-G®外泌体制备平台以创新3D固定化培养技术为核心,整合自动化生物反应器与TFF浓缩系统,实现了EVs的高效产出和高效分离,终产品质量可控,为EVs疗法的规模化制备提供了一站式解决方案。
1. Journal of Extracellular Vesicles, 2025; 14:e70110
2. MISEV (Minimal Information for Studies of Extracellular Vesicles 2018 and 2023)
3. Bang, O. Y., E. H. Kim, Y. H. Cho, et al. 2022. “Circulating Extracellular Vesicles in Stroke Patients Treated With Mesenchymal Stem Cells: A Biomarker Analysis of a Randomized Trial.” Stroke 53, no. 7: 2276–2286.
4. Chen, C., N. Cai, Q. Niu, Y. Tian, Y. Hu, and X. Yan. 2023. “Quantitative Assessment of Lipophilic Membrane Dye-Based Labelling of Extracellular Vesicles by Nano-Flow Cytometry.” Journal of Extracellular Vesicles12, no. 8: 12351. Cho, Y. W., M
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
