-
新闻
华东理工×同腾新创联合突破:3D培养外泌体产量飙升16倍,秘密在于细胞骨架重塑!
发布日期:2025-04-28
在前述研究中证实了在等体积规模下三维培养条件(3D)外泌体产量显著高于传统二维培养条件(2D),在CEL-G® Culture Ad60系列固定床生物反应器(Ad60 FBR)中使用以人脐带间充质细胞(hUC-MSCs)为代表的多种细胞制备外泌体的研究中发现其产量优势可以达到等体积规模下细胞工厂产量的20-30倍。针对细胞培养上清液使用CEL-G® TFF Lab系列外泌体浓缩系统(TFF Lab)分离外泌体,多次测试数据显示外泌体浓缩后回收率超过50%,杂蛋白去除率大于95%。
过往研究主要集中在利用3D培养的高产量优势制备外泌体,但该培养模式下外泌体的高效产出机制并不明确。近期,华东理工大学与同腾新创合作研究,共同探讨了3D培养条件下外泌体生物发生和分泌的关键机制,并基于此机制利用Ad60 FBR大规模制备了高产量的外泌体。该研究发现,3D培养通过降低整合素β1的表达促使细胞骨架中皮质肌动蛋白解聚从而降低了外泌体的释放难度;其次是RAS相关C3肉毒毒素底物1 (RAC1)的表达增加导致肌动蛋白在多囊泡体(MVB)膜上的聚集,增强了MVB质膜融合释放腔内囊泡(ILV)的过程,从而促进了外泌体的产生及分泌。基于对3D培养通过调节肌动蛋白聚集和解聚来促进外泌体的生物合成和分泌机制的理解,该研究优化了一种无血清培养基,通过在2 m2培养面积的Ad60 FBR中培养hUC-MSCs制备外泌体,与2D培养相比单细胞的外泌体产量增加了16倍,共收获了2.6×1014个外泌体颗粒,并使用TFF Lab从上清液中分离外泌体,回收率高达61.5%。通过这种策略的组合,该研究建立了一种使用固定床生物反应器无血清培养基大规模生产以及使用切向流系统分离外泌体的方法,为未来大规模生产设备的应用铺平了道路。并且研究发现3D培养条件下高产量的外泌体产物在体外血管生成、免疫调节及伤口修复中具有更加优异的效果。综上所述,该研究对无血清3D培养制备外泌体的高效产出机制研究及其优于2D培养产物生物活性的治疗应用具有重要意义。
该研究来自于华东理工大学生物反应器工程国家重点实验室,研究中使用的PET膜材、Ad60 FBR及TFF Lab系同腾新创(苏州)科技有限公司自主研发(图1)以下为主要研究结果。
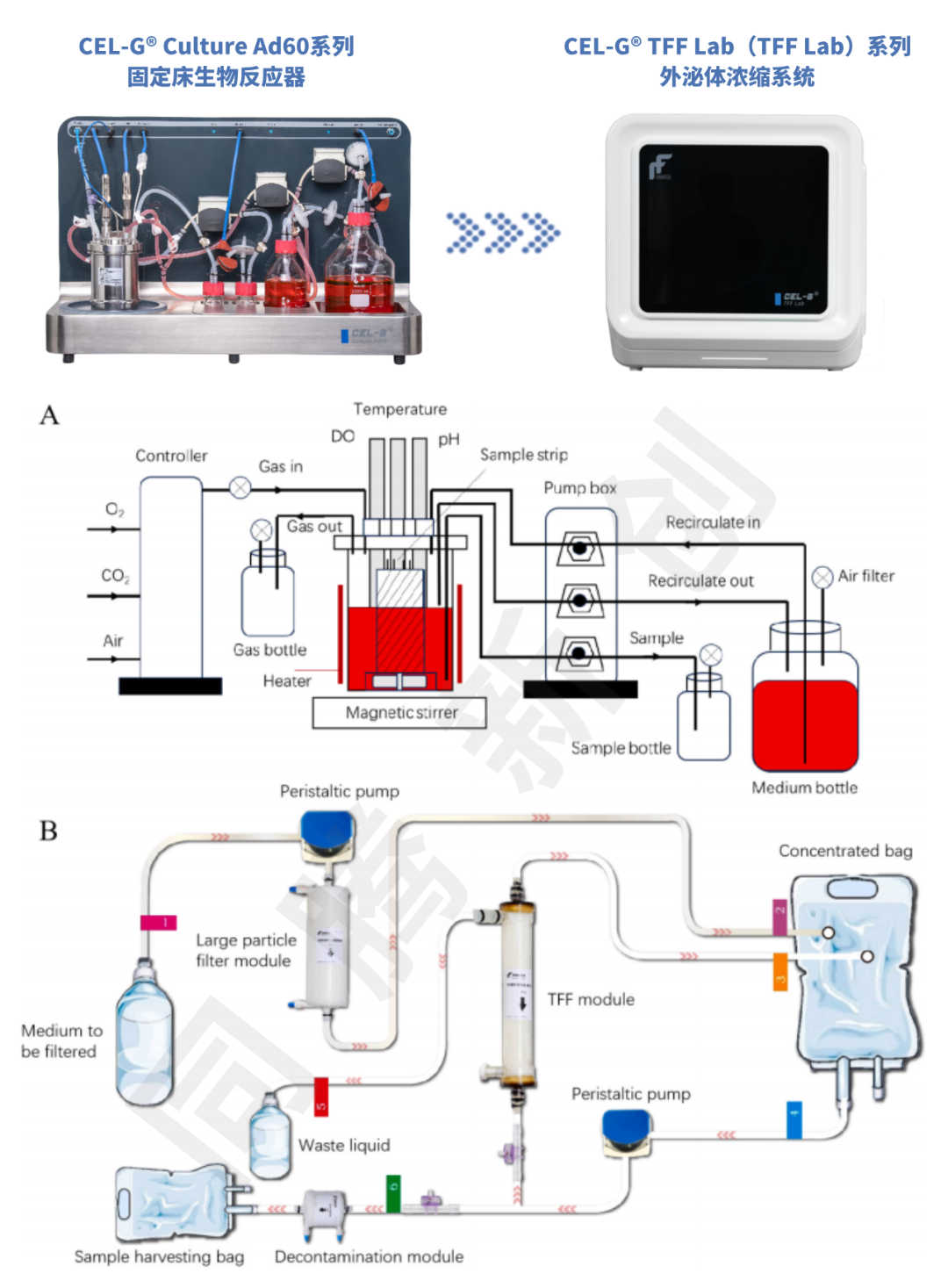
图1 Ad60 FBR和TFF Lab整体外观及结构示意图
外泌体是由细胞分泌到细胞外的纳米级双层囊泡,含有多种生物活性分子,如脂质、蛋白质和核酸。这些囊泡作为疾病的新生物标志物以及用于无细胞治疗和药物递送系统显示出巨大的潜力。外泌体是通过质膜的多次内陷产生的,质膜向内折叠以在细胞内形成早期内体。在成熟过程中,这些膜内陷将货物运输到管腔内囊泡(ILV),所述囊泡通过各种分选途径聚集形成多泡体(MVB)。MVB的生物发生、囊泡易位、囊泡锚定以及囊泡融合和分泌的过程都需要肌动蛋白和肌球蛋白来维持细胞骨架结构并促进转运动力学,这对于外泌体生物发生和分泌至关重要。
外泌体的产量与细胞数量、细胞活力和单细胞产量相关。在临床试验中,每个患者通常需要大约0.5 × 1011-1.4 × 1011个外泌 体。然而目前外泌体生产过程中,单细胞外泌体的实际产量很低,并且细胞数量的扩展性仍然是一个挑战,很难满足临床对大剂量外泌体的需求。目前针对间充质干细胞的外泌体生产开发出了细胞遗传修饰、细胞预处理、囊泡类似物的产生、3D培养和培养基组成的优化等一系列策略。其中,3D培养能够模拟细胞的体内形态和生长环境,同时具备较大的生长面积、高密度、机械刺激、流体流动质量传递和细胞聚集等影响因素能够显著影响外泌体生物发生和分泌,使得3D培养成为提高外泌体产量的重要策略。然而大多数现有的研究依赖于2D培养,3D培养如何增加外泌体产量的潜在机制仍不清楚。因此理解这些机制对于优化用于大规模外泌体生产的3D培养系统和进一步提高单细胞的外泌体产量至关重要。
首先是,利用培养hUC-MSCs细胞在3D培养模式下进行外泌体产量分析,其次是通过对2D及3D培养模式下细胞形态差异观察衍生到细胞骨架变化追踪,并通过对皮质肌动蛋白解聚状态分析追踪其上游分子整合素β1作用机制,再分析研究过程中发现的胞内囊泡上肌动蛋白聚集的现象并确认RAC1的作用机制,从以上机制层面解析3D培养下外泌体生产的高产量优势,最后通过固定床生物反应器制备大规模的外泌体分析其产量情况,并通过体外体内验证2D及3D培养模式下外泌体生物活性,确定了3D培养模式下外泌体具备更优的生物活性。
通过测量外泌体蛋白浓度和颗粒数以评估2D和3D培养之间外泌体产量的差异。透射电子显微镜(TEM)(图2A),纳米颗粒跟踪分析(图2B),和蛋白质印迹分析(图2C)显示分离的颗粒是外泌体。3D组相较于2D组数据对比显示出单细胞的外泌体蛋白量增加了4.0倍(图2D)、单细胞外泌体颗粒数量增加4.8倍(图2 E)。另外在两组之间没有观察到外泌体的平均大小的显著差异(图2F)。研究结果表明,3D培养显著地提高了细胞外泌体的产量。
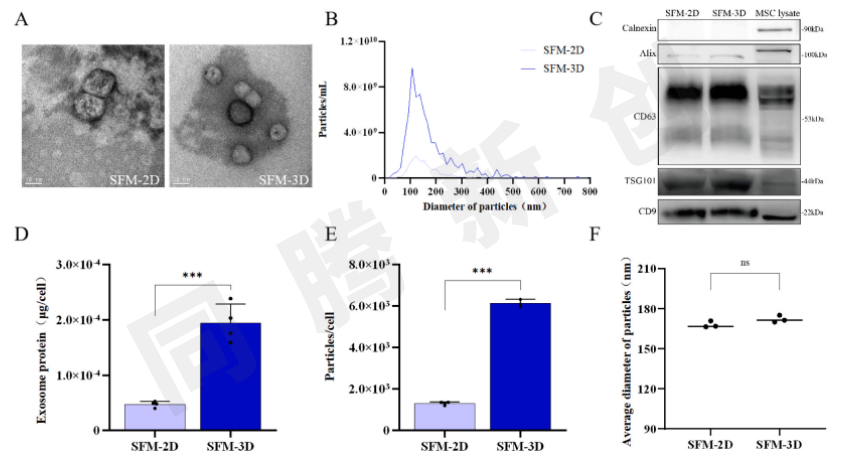
图2 外泌体表征和单细胞外泌体产量对比
在2D培养中观察到的纺锤形形态相比,PET膜材上培养的细胞由于聚集而变圆(图3A)。共聚焦成像结果进一步证实了两组细胞显示出不同的形态(图3B)和纵横比(图3C)。同时细胞形态与细胞骨架的聚集和解聚状态密切相关。研究分析了2D和3D培养的细胞中肌动蛋白的基因和蛋白表达,结果表明,与2D组相比,3D培养的细胞中总肌动蛋白表达显著增加(图3D)。另外,3D组细胞内G-actin/F-actin蛋白比值显著高于2D组(图3E),表明3D培养中的细胞骨架处于更加解聚的状态。研究结果表明,使用PET膜在3D中培养细胞显著改变了细胞形态并减少了细胞内细胞骨架蛋白的聚集。
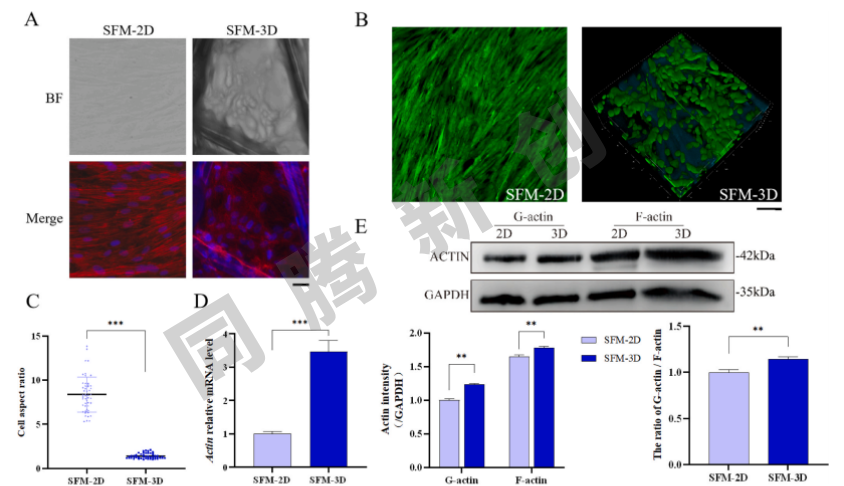
图3 2D/3D培养条件下的细胞形态和肌动蛋白表达量分析
当MVB移位至质膜时,细胞内皮质肌动蛋白层充当物理屏障,当其解聚会促进外泌体的分泌。为了研究皮质肌动蛋白解聚对外泌体分泌的影响,用不同浓度的肌动蛋白聚合抑制剂细胞松弛素处理2D培养的细胞4 h,观察细胞骨架的变化,结果表明,随着细胞松弛素浓度的增加,细胞逐渐变得皱缩(图4A),细胞活力降低(图4B),并且单细胞的外泌体蛋白量在除低浓度测试组外均显著增加(图4C),这些结果表明,皮质肌动蛋白层解聚会导致囊泡脱离促进外泌体释放。整合素是通过细胞内尾部连接到肌动蛋白丝的跨膜受体,通过促进F-肌动蛋白的形成在肌动蛋白组装中起关键作用。在2D和3D培养的细胞中进一步分析了ITGB 1的基因和蛋白表达。结果表明,与2D培养的细胞相比,3D培养的细胞中ITGB 1基因表达显著降低(图4D),并且在蛋白质水平上观察到相同的趋势(图4E)。在2D培养组中,皮层肌动蛋白层保持完整,而在2D+CytD组和3D培养组中,外周皮层肌动蛋白层明显被破坏。此外,在细胞内区域观察到多个红色突出显示的区域,其可能代表破坏的细胞内空间中的肌动蛋白聚集体(图4F)。总之,3D培养通过降低整联蛋白β1表达促使皮质肌动蛋白层的解聚增强外泌体分泌并增加外泌体产生。
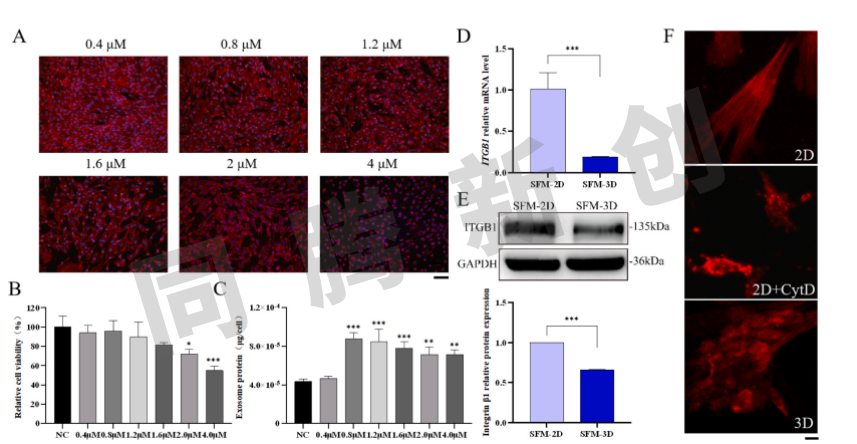
图4 3D培养通过整合素β1介导的皮质肌动蛋白解聚提高外泌体的产生
在检测皮质肌动蛋白的聚集和解聚状态时,在2D+CytD组和3D组的细胞中都观察到多个红色亮点(图4F),这被认为代表了肌动蛋白细胞内的异常聚集。这表明3D培养也可能促进细胞内肌动蛋白聚集。在外泌体生物发生期间,由RAC1介导的MVB膜上的肌动蛋白成核在将外泌体分装到ILV中起关键作用。与2D培养组相比,3D培养组中RAC1的mRNA表达(图5A)和蛋白质表达(图5B)显著更高。为了进一步探讨肌动蛋白聚集体与MVB膜的关系,分别用罗丹明标记的鬼笔环肽和CD63标记肌动蛋白和MVB,并对它们的共定位进行评估,结果显示,与2D组相比,2D+CytD组和3D组的细胞内区域的肌动蛋白聚集体与CD 63显著共定位(图5C)。综上结果来看,3D培养通过提高细胞内RAC1表达介导MVB膜上的肌动蛋白成核来增强外泌体生物发生并增加外泌体产生。
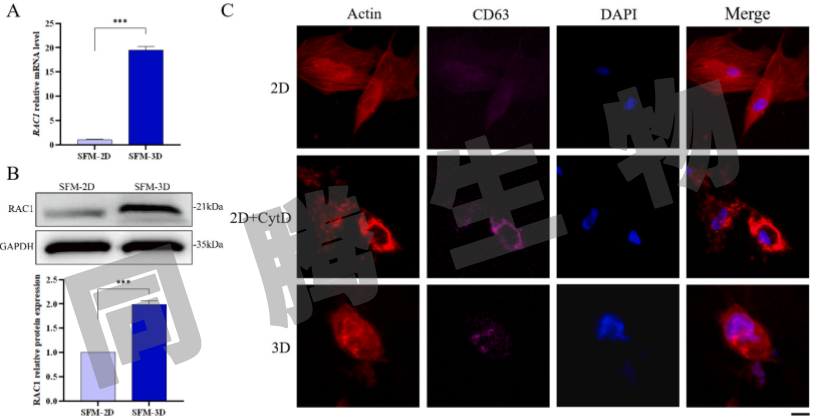
图5 3D培养通过增加RAC1表达影响肌动蛋白聚集和外泌体生物发生
基于3D培养通过整合素β1和RAC1影响细胞骨架来增强外泌体产生的发现,选择了已知影响皮质肌动蛋白或MVB肌动蛋白的青蒿素、白藜芦醇和GDP为添加成分开发出了一款无血清培养基。并使用Ad60 FBR培养和无血清培养基联合策略进行了来源于hUC-MSCs的外泌体的大规模生产。在培养过程中细胞数量及汇合度在载体膜材上随时间逐渐增加(图6A)。通过使用无血清培养基进行培养基交换,共收获了五个批次含有外泌体的上清液。与2D培养组相比,单细胞的外泌体蛋白表达量增加高达12.1倍(图6B),单细胞的外泌体颗粒数增加了16.0倍(图6C),在Ad60 FBR中单批次收获的外泌体颗粒浓度最高为6.1×1010Particles/mL,显著高于2D组中的6.9×109Particles/mL(图6D)。五个批次共收获外泌体颗粒总数达到2.6×1014 Particles。考虑到每个患者至少需要0.5×1011-1.4×1011个外泌体,此外泌体生产系统可能满足至少1857名患者的治疗需求。同时测试过程中有几个操作参数是固定的,后期可以进行优化以获得更高的外泌体产量。
培养上清收获后,使用TFF Lab从培养物上清液中分离外泌体,最终收获了总计1.6×1014 Particles的外泌体,回收率测算为61.5%,显著高于通过沉淀法的21.7%回收率(图6E,F)。这些结果表明,使用结合3D培养的Ad60 FBR与TFF Lab分离纯化的组合策略使得能够大规模、无血清、自动化生产hUC-MSCs衍生的外泌体,并且外泌体产率相较于传统方法显著增加。
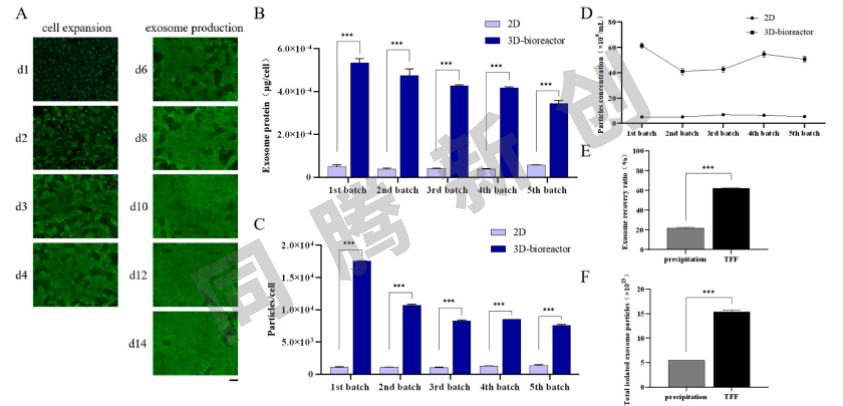
图6 使用Ad60 FBR大规模生产外泌体和TFF Lab分离纯化外泌体
来源于间充质干细胞的外泌体具有一系列生物学功能,包括促进血管生成、免疫调节、抗纤维化和细胞增殖。通过使用固定床反应器3D培养来实现大规模外泌体生产。然而,诸如细胞性质、培养基组成、外泌体的产生和培养方法显著影响外泌体的数量及其内容物的组成,从而影响其生物学功能。因此,评价外泌体的生物学功能以探索其在多种临床应用中的潜力至关重要。
为了评价从2D/3D培养模式与无血清培养基组合获得的外泌体的体外血管生成生物活性,将外泌体和自体荧光红内皮细胞(HUVEC)与膜染料共孵育,发现HUVEC内出现多个明亮的绿色荧光点(图7A),表明两种来源的外泌体均能够成功内化。细胞划痕实验测定的结果显示,用2D/3D培养模式制备的外泌体处理的HUVECs的划痕愈合率显著高于基础培养基的阴性对照组(基础培养基:11.8%; 2D:50.8%; 3D:54.6%)。在血管形成测定中,与生长培养基相比,2D和3D都显著增加了HUVEC形成的环和结节的数量(图7 D-F)。在3D组中形成的结节数量显著高于2D组。这些发现表明,3D组生产的外泌体与2D组相比,在体外具有更强的血管生成能力。在免疫调节能力方面,使用3D培养策略产生的外泌体显示出增强的调节巨噬细胞极化的能力,能够抑制巨噬细胞向Ml促炎型的极化(图7G)并促进向M2抗炎型的极化(图7H)。与2D组相比,使用3D策略产生的外泌体在体外表现出更好的免疫调节能力。这可能归因于促血管生成和免疫调节蛋白和miRNA的多重负载。
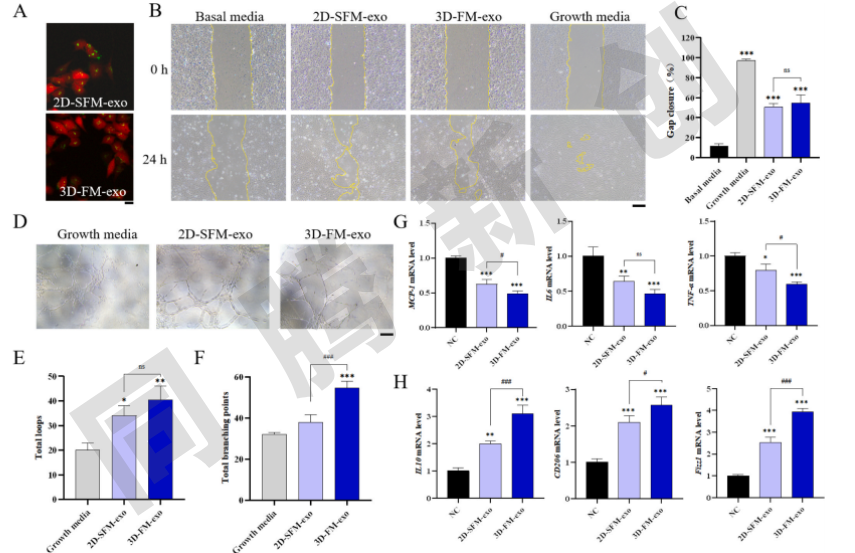
图7 外泌体体外血管生成和免疫调节能力测定
为了进一步评估使用3D培养和无血清培养基组合策略产生的外泌体的体内伤口愈合能力,进行了小鼠伤口愈合实验。结果显示,到第14天,NC组仍保留一小面积未愈合的伤口,而2D和3D组的伤口均完全愈合,毛发也已再生(图8A)。其中,第3天观察,3D组的伤口愈合率(39.0%)明显高于2D组(27.5%)。伤口修复后期2D与3D两组之间没有观察到显著差异是由于D3观察后没有归位外泌体水凝胶(图8B)。14天伤口的组织切片用H&E和Masson三色染色,以评估疤痕形成、血管密度和皮肤再生。NC组的伤口区域存在很大的缝隙,而2D和3D组的伤口均已完全闭合。H&E染色显示,与2D组相比,3D组具有更厚的表皮层、更多的微血管(由黑色箭头指示)和更多的皮肤附着物,包括毛囊和皮脂腺。Masson染色表明,2D和3D组的胶原形成均组织良好,排列性比NC组更好(图8C)。综上来看,2D培养和3D培养策略产生的外泌体均表现出优异的体内伤口修复能力。在伤口愈合的早期阶段,3D培养的外泌体在促进伤口修复方面显示出比2D培养来源外泌体更优异的功效。
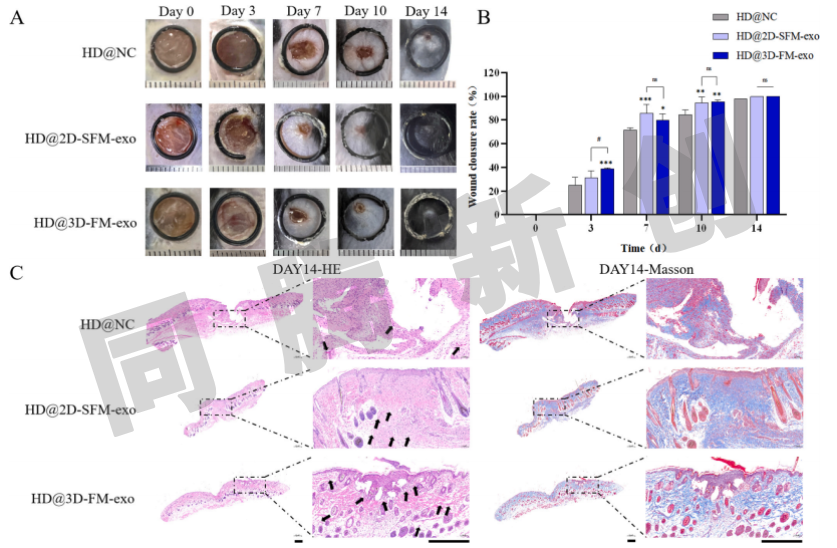
图8 外泌体水凝胶加速伤口闭合
干细胞来源的外泌体作为一种无细胞治疗药物,具有广泛的生物学功能。虽然目前的研究主要是检查外泌体内容物(包括它们的生物学功能、作用机制和临床应用),这些领域的研究已经取得了许多的进展。然而,诸如产量低、可扩展性差和无血清生产的需求等挑战仍然是外泌体广泛应用的障碍。该研究揭示了3D培养增强了外泌体分泌和生物发生的两种不同的机制途径:通过减少整合素β1的表达,导致皮质肌动蛋白的解聚,以及通过增加RAC1的表达,促进肌动蛋白在多囊泡膜上的聚集。基于此机制,利用3D培养固定床生物反应器以及无血清培养基成功实现了大规模外泌体的高效生产,并验证了3D培养模式下外泌体更加优异的体外体内生物学功能。
未来,基于该研究的发现,可以通过细胞工程方法或精确的修饰系统制备靶向血管生成和免疫调节关键调节因子的外泌体,同时使用无血清培养体系,结合同腾新创Ad60 FBR以及TFF Lab等适宜大规模外泌体制备的系统设备,有望建立商业化规模的外泌体生产平台,推动外泌体临床治疗应用落地。
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
