-
新闻
工程化外泌体:精准“狙击”肿瘤,改写癌症免疫治疗格局
发布日期:2025-04-28
近年来,癌症仍是全球疾病和死亡的主要原因。2020年,全球新增癌症病例1930万例,癌症相关死亡病例约1000万例,预计到2040年,全球癌症发病率将攀升至2840万例[1]。传统疗法如化疗、放疗和免疫治疗虽取得了一定进展,但仍面临特异性不足、毒副作用强及药物耐药性等问题。因此,开发高效、低毒的新型治疗策略迫在眉睫。
细胞外囊泡(EV),尤其是外泌体,因其生物相容性、低免疫原性和高效递送能力,成为癌症治疗的突破性方向。2025年3月28日,《Journal of Extracellular Vesicles》发表了一项研究[2],通过工程化EV递送免疫调节剂至肿瘤微环境,成功激活抗原特异性CD8+ T细胞,将“冷”肿瘤转化为“热”肿瘤,显著增强了抗PD-1疗法的效果。此外,人源化抗原呈递EV实现了对肿瘤抗原特异性CD8+ T细胞的选择性刺激,这一研究为癌症免疫治疗提供了新视角。
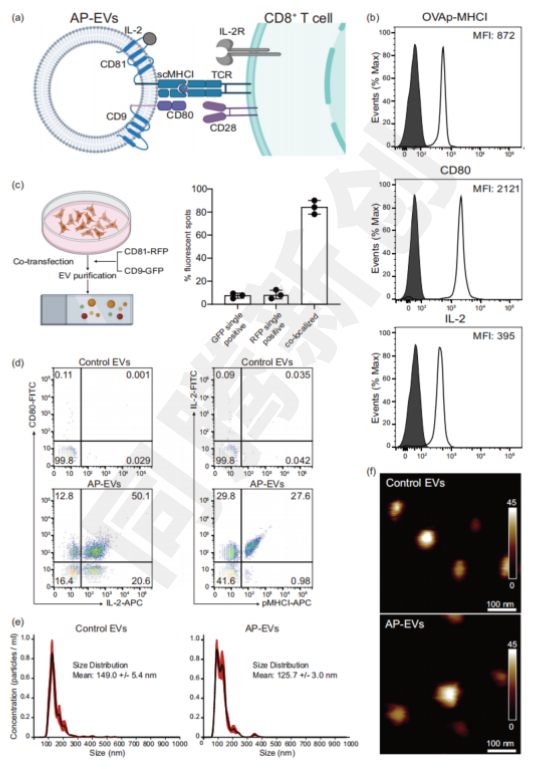
研究团队成功构建了抗原呈递EV(AP-EV),使其共表达肽主要组织相容性复合体1类(pMHC class I)、共刺激分子(CD80)和细胞因子(IL-2)。AP-EV的平均粒径为150 nm,形态与天然EV一致(Figure 1)。
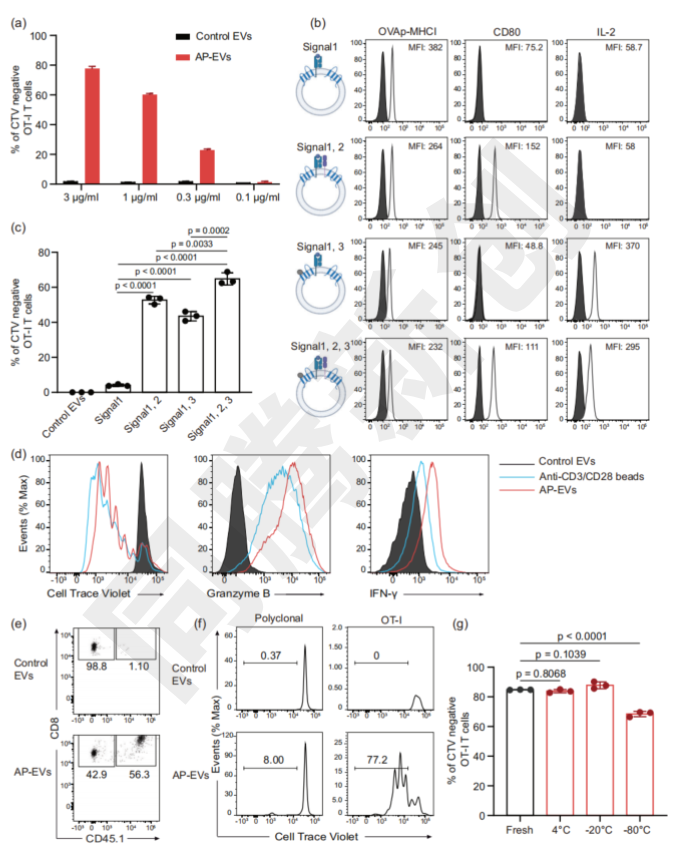
Figure 1. 抗原呈递EV(AP-EV)的构建及表征
实验结果表明,pMHC class I、CD80和IL-2的协同作用是激活T细胞的关键,AP-EV能够实现抗原特异性CD8+ T细胞的选择性扩增(Figure 2)。

Figure 2. AP-EV 直接激活抗原特异性CD8+ T细胞
实验结果表明,AP-EVs在体内选择性扩增抗原特异性CD8+ T细胞(OT-I),并主要富集于脾脏和肝脏,且给药后4天仍保持活性。相比IL-2/抗IL-2 mAb的非特异性激活,AP-EVs避免了脾肿大等副作用,证实其靶向性和安全性优势(Figure 3)。

Figure 3. AP-EV 在体内激活抗原特异性CD8+ T细胞
AP-EV不仅扩增内源性抗原特异性CD8+ T细胞,还显著抑制肿瘤生长(Figure 4)。
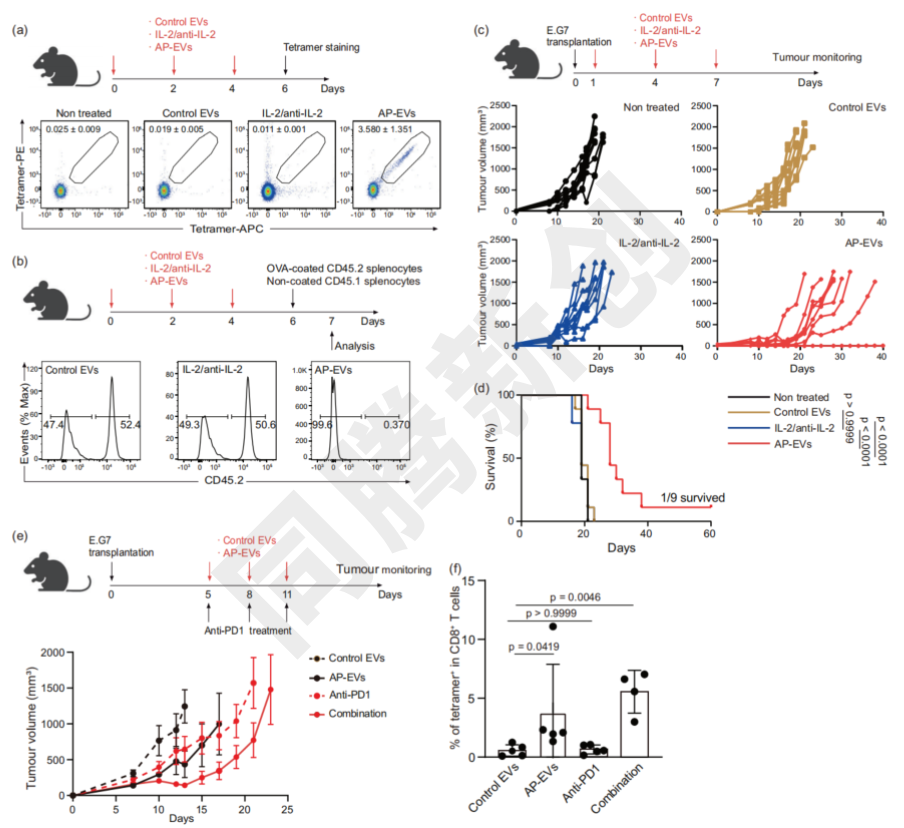
Figure 4. AP-EV给药对抗癌免疫的影响
实验结果表明,经AP-EV治疗后,CD8+ T细胞扩增比例从0.025%提升至3.58%,肿瘤体积缩小70%。联合抗PD-1疗法可进一步抑制肿瘤生长并延长生存期(Figure 5)。
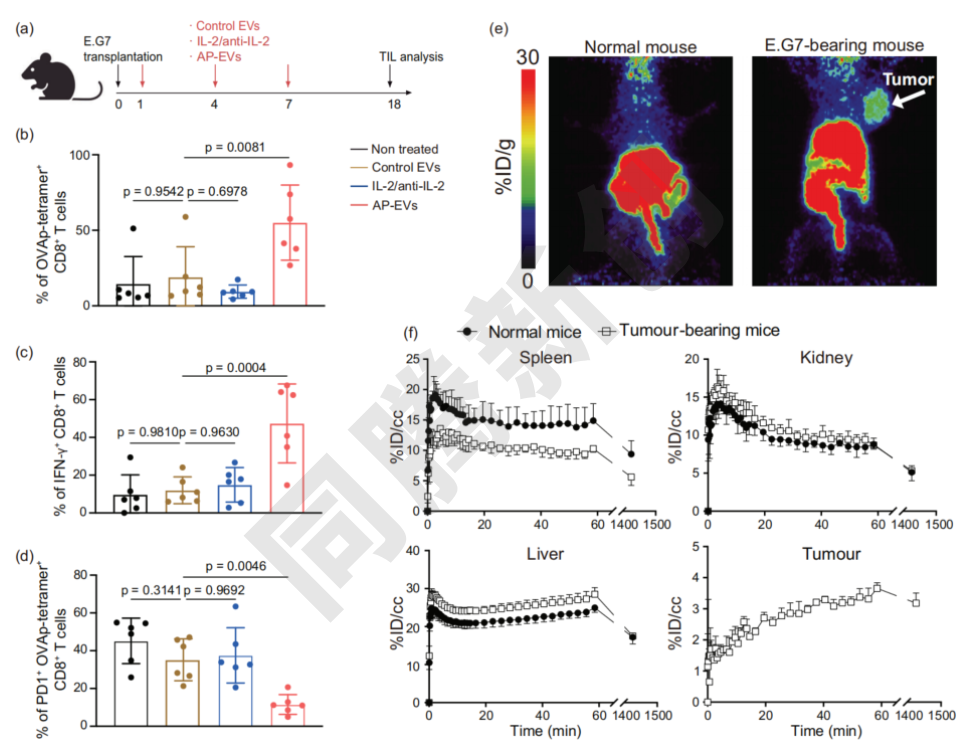
Figure 5. AP-EV对内源性抗原特异性CD8+ T细胞扩增和癌症免疫的影响
AP-EVs在肿瘤部位富集,提升了IFN-γ+ CD8+ T细胞的比例,减少了耗竭型T细胞,从而将“冷”肿瘤转化为“热”肿瘤(Figure 6)。
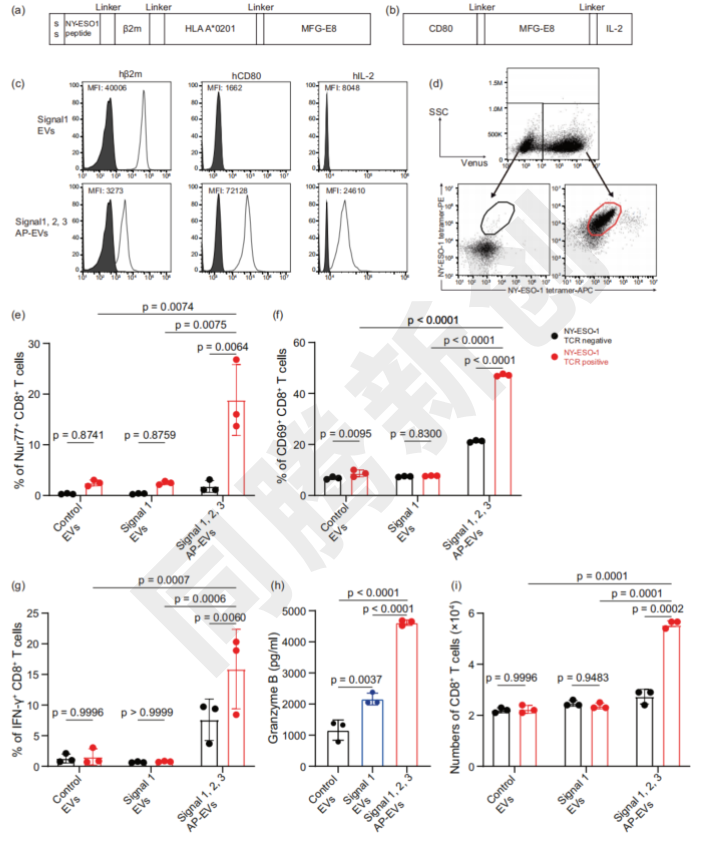
Figure 6. AP-EV 可以直接激活 TIL
人源化AP-EVs能够成功刺激原代人CD8+ T细胞,为临床转化奠定了基础(Figure 7)。

Figure 7. AP-EVs 在体外诱导人抗原特异性 T 细胞扩增、激活和效应功能
工程化外泌体的大规模生产依赖于高效的培养与提取技术。那么,如何解决工程化外泌体大规模生产和外泌体提取的问题呢?美国马萨诸塞州大学的科学家们在2018年第26期《Molecular Therapy》杂志上发表了一篇题为“Exosomes Produced from 3D Cultures of MSCs by Tangential Flow Filtration Show Higher Yield and Improved Activity”的文章,该文章影响因子高达11.454分[3],其研究为工程化外泌体的生产和提取问题提供了答案。该文章综述了切向流过滤(TFF)是一种从大量细胞培养基中浓缩蛋白质或病毒的方法,并验证了与2D培养相比,3D培养产生的外泌体(3D-UC-外泌体)是2D培养物(2D-UC-外泌体)的20倍;通过结合3D间充质干细胞培养与切向流过滤(TFF),外泌体产量(3D-TFF)达到超速离心法(3D-UC)的7倍;比较2D或3D培养物的外泌体以及由UC或TFF产生的外泌体的物理化学特性,3D培养和TFF都将外泌体的产量提高到140倍的累积程度,这一技术组合不仅提升产量,还保持了外泌体的完整性和生物活性(Figure 8-9)。
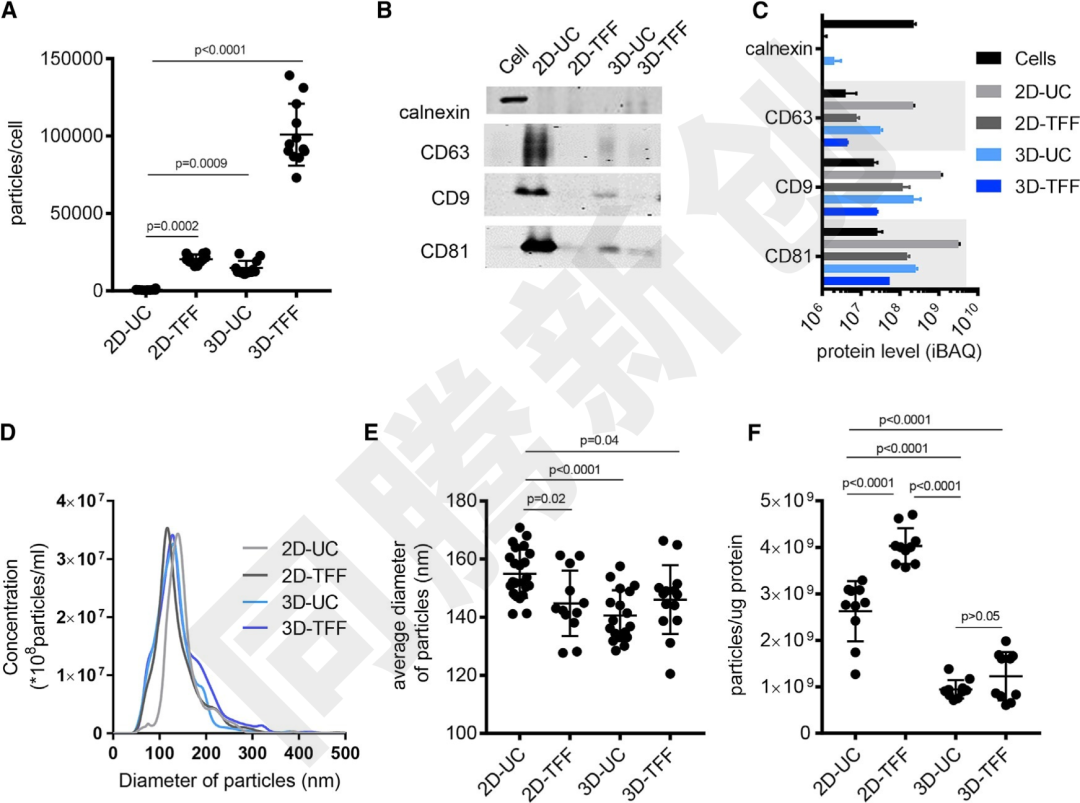
Figure 8. 2D和3D培养与外泌体UC、TFF分离方法比较
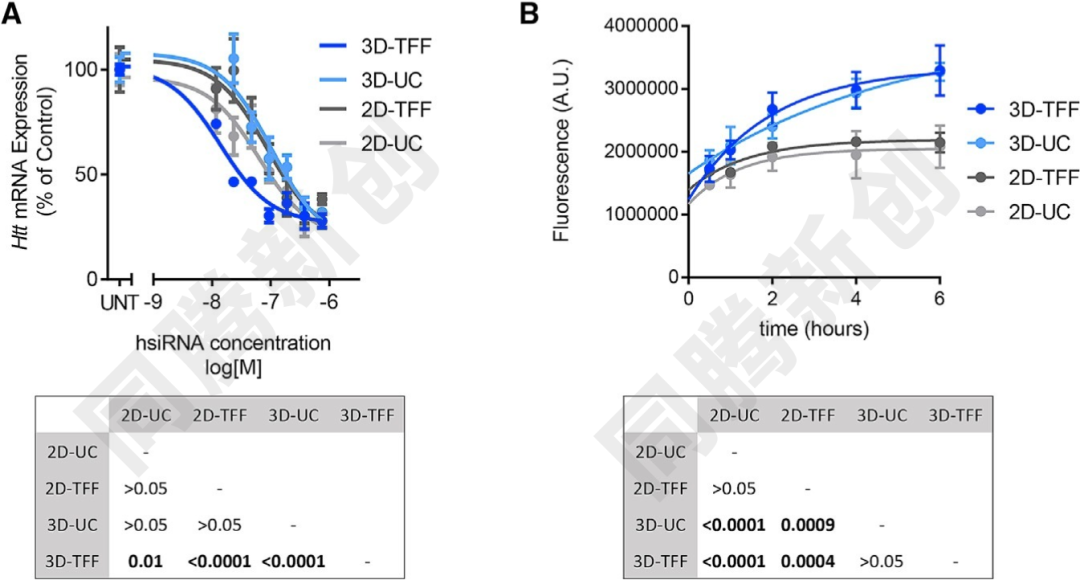
Figure 9. 2D-UC、2D-TFF、3D-UC、3D-TFF外泌体表征比较
培养结合TFF系统提取外泌体
既能高效获取大量外泌体,又能高效加载siRNA
外泌体的完整性对于其生物活性至关重要。通过超速离心(UC)和切向流过滤(TFF)从2D和3D培养物中分离的外泌体具有相似的大小分布和蛋白质含量。然而,3D-TFF外泌体在siRNA递送到神经元和诱导mRNA沉默方面更有效。与2D-UC外泌体相比,3D-TFF外泌体在治疗性小干扰RNA(siRNA)转移到原代神经元的能力高出7倍(Figure 10)。
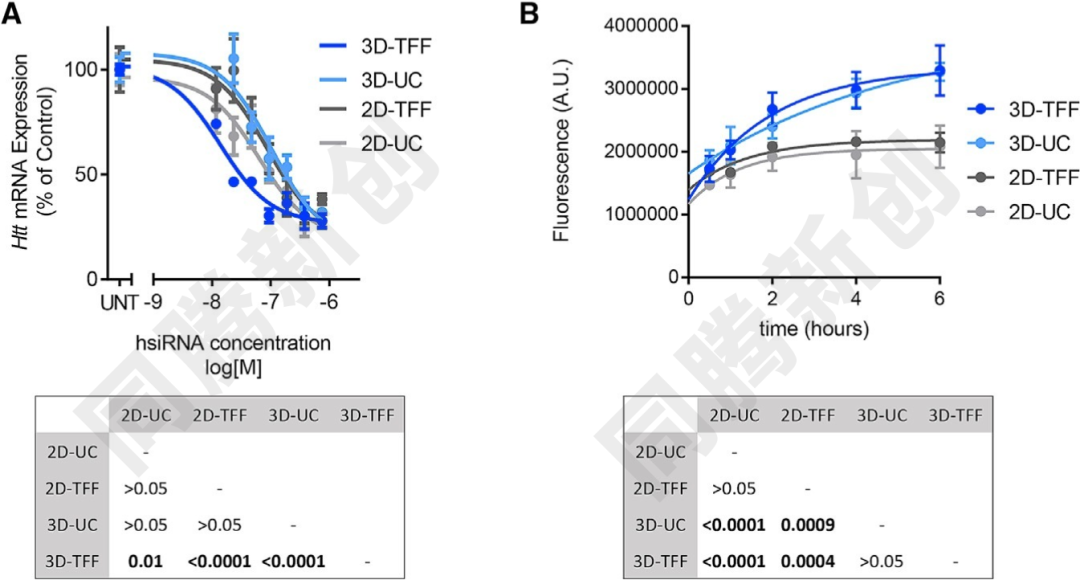
Figure 10. 外泌体将亨廷顿(Huntingtin)siRNA传递给神经元能力比较
为了满足科研和临床的需求,加快工程化外泌体行业的发展,同腾新创开发了CEL-G®外泌体一站式制备平台(Figure 11)。CEL-G®系列产品主要包括CEL-G®Culture MSC无血清培养基、CEL-G®Culture Ad60固定床生物反应器、CEL-G®TFF Lab外泌体浓缩系统,GMP 兼容的生产和纯化方法,为行业提供自动化、封闭式、规模化的一站式生产解决方案(Figure 11)。

Figure 11. 同腾新创CEL-G®外泌体一站式制备平台
上游生产:固定床生物反应器实现
低剪切力、高效、稳定的3D培养
CEL-G® Culture Ad60 系列固定床生物反应器可实现工程化外泌体的大规模生产。其独特的3D培养设计提供低剪切力环境,支持多种细胞的高密度培养及外泌体高效收获。全封闭自动化生产结合智能控制系统,精准优化培养条件,降低污染风险,确保细胞健康和外泌体稳定分泌。系统支持多批次连续收集,提高生产效率,并减少批次差异,保证外泌体质量均一,符合GMP标准。
CEL-G® TFF Lab 系列外泌体浓缩系统可实现工程化外囊泡的大规模分离纯化。该系统采用多级程序化设计,支持自动化浓缩富集,操作高效便捷。用户可灵活调节收获体积,并通过人机交互界面实时监控参数,全程符合GMP规范。配备一次性封装耗材包,可快速完成高倍浓缩与定量收获,减少人工干预,降低操作误差。处理过程静音稳定,所得外泌体纯度高、活性好,符合外泌体鉴定标准,适用于规模化生产。
当前,癌症治疗领域正迎来一场革命性突破,工程化外泌体凭借其精准靶向递送能力,成为癌症免疫治疗的新型有力工具。研究团队通过设计抗原呈递EV,成功将免疫调节剂递送至肿瘤浸润淋巴细胞,激活抗原特异性CD8+ T细胞,将"冷"肿瘤微环境转化为"热"微环境,从而有效抑制肿瘤生长。虽然该技术仍需优化安全性和规模化生产流程,但其在激活肿瘤微环境免疫应答及联合治疗方面的潜力已得到初步验证。同腾新创CEL-G®平台为工程化细胞外囊泡规模化生产提供了高效解决方案,通过3D细胞培养结合TFF技术,显著提升了EV的产量与活性,有望为癌症患者提供更高效、低毒性的治疗选择,推动免疫治疗进入新时代。未来,随着技术的进一步成熟和临床应用的拓展,工程化外泌体或将成为个性化癌症治疗的重要组成部分,为更多患者带来希望。
[1] Huang R, Zhu J, Fan R, et al. Extracellular vesicle-based drug delivery systems in cancer [J]. Extracellular Vesicle, 2024, 4: 100053.
[2] Lyu X, Yamano T, Nagamori K, Imai S, Van Le T, Bolidong D, Ueda M, Warashina S, Mukai H, Hayashi S, Matoba K, Nishino T, Hanayama R. Direct delivery of immune modulators to tumour-infiltrating lymphocytes using engineered extracellular vesicles. J Extracell Vesicles. 2025 Apr;14(4):e70035. doi: 10.1002/jev2.70035. PMID: 40154979; PMCID: PMC11952836.
[3] Haraszti RA, Miller R, Stoppato M, Sere YY, Coles A, Didiot MC, Wollacott R, Sapp E, Dubuke ML, Li X, Shaffer SA, DiFiglia M, Wang Y, Aronin N, Khvorova A. Exosomes Produced from 3D Cultures of MSCs by Tangential Flow Filtration Show Higher Yield and Improved Activity. Mol Ther. 2018 Dec 5;26(12):2838-2847. doi: 10.1016/j.ymthe.2018.09.015. Epub 2018 Sep 22. PMID: 30341012; PMCID: PMC6277553.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
