-
新闻
华东理工×同腾生物联合突破:固定床反应器慢病毒生产国产化新策略
发布日期:2025-03-17
前述研究优化了使用6孔板、6孔板3D固定床模型和CEL-G® Culture Ad60固定床反应器(Ad60 FBR)瞬时转染含绿色荧光蛋白copGFP的LVs包装质粒TT-CP1的工艺策略,并确认了TT-CP1质粒在AD60 FBR中能够成功产出表达。
前述研究文章:案例应用丨慢病毒生产界的“光速引擎”!CEL-G® Culture Ad60 固定床反应器让转染效率飞起来!
本文接下来将介绍AD60 FBR在慢病毒生产过程又一典型的应用案例,该研究对慢病毒生产过程中质粒转染条件和细胞培养参数进行了工艺测试及优化,并使用优化后的工艺条件在表面积为2m2的AD60 FBR验证测试收获了高达2.4×1010 TU产量的慢病毒。研究结果为建立基于AD60 FBR的慢病毒载体高效生产工艺提供了强有力的数据支撑。
该研究结果来自于华东理工大学生物反应器工程国家重点实验室,研究过程中使用的PET膜材及AD60 FBR系上海同腾生物科技有限公司自主研发。文末可查看原文,以下为主要研究结果。
固定床反应器制备
慢病毒载体的需求及应用
基因治疗能将外源遗传物质转移到患者细胞中,通过抑制或增强基因表达、修正靶基因,从而实现疾病的治疗。而在诸多外源基因的转移方法中,慢病毒载体具有巨大的应用潜力。慢病毒属于逆转录病毒科中的复杂逆转录病毒,大多由人类免疫缺陷病毒-1 (Human Immunodeficiency Virus Type 1, HIV-1) 改造而来,能够同时转导分裂及非分裂期细胞,具有将外源基因稳定整合至宿主细胞基因组的能力。目前慢病毒载体的应用市场广阔且前景可观,预计2026年慢病毒市场将增长至8亿美元。
慢病毒的生产主要使用贴壁生长的HEK293T细胞,为实现慢病毒的生产,需要对HEK293T细胞进行规模化培养。目前较多使用的细胞工厂制备工艺路线生产LVs具有多重限制,其中包括且不限于收获时间限定较紧、人工劳动强度大、系统操作多为开放式并且需要大量的培养箱空间,这些限制为后续商业化规模的病毒制备带来了压力,为了克服当前工艺的局限性,固定床生物反应器这种扩展性高的三维贴壁培养体系正在逐渐应用流行,其中商业化较为成熟的固定床反应器包括 Pall 公司的iCELLis 和 Univercells 公司的 Scale-X 以及国产品牌上海同腾生物的AD60 FBR。
AD60 FBR反应罐体内填充有固定化细胞的固相载体PET膜材料(Fig.1),可以为细胞贴附生长提供适宜的介质类型、气体控制、温度控制及pH控制等多重精细化支持。当细胞被搅拌驱动拦截在双层螺旋缠绕的PET膜材空隙中时,培养液流经后与细胞进行传质传氧,这种培养方式极大的避免了搅拌引发的剪切力及碰撞造成的细胞损伤等。相对于细胞工厂而言,固定床反应器有着明显的培养面积优势,AD60 FBR培养面积设计为1 m2/2 m2、20 m2以及60 m2,对应的细胞工厂层数(细胞工厂每层培养表面积0.063m2)分别是16/32层、320层以及950层,放大规模的AD600 FBR培养面积则高达300 m2/600 m2,对应的细胞工厂层数更是达到了4800层/9600层。另外细胞在AD60 FBR培养过程中的分布十分均匀,能对后续批次重复及放大提供稳定性与重复性支持,从而能加快产品上市速度。

Figure 1 AD60 FBR反应器及载体膜材示意图
慢病毒生产工艺的
测试及优化参数选择
在使用固定床反应器生产慢病毒的过程中,转染条件(如转染时DNA的浓度、转染试剂与DNA的比例)以及细胞培养操作参数 (如接种密度、转染时的细胞密度等)均能够影响慢病毒的生产。为了实现高效的慢病毒生产,需要探究转染条件对转染效率的影响和操作参数对慢病毒滴度的影响,据此设计并开发慢病毒生产工艺。
研究结果
本研究首先考察了转染试剂聚乙烯亚胺 (Polyethyleneimine, PEI)与DNA 的混合比例、混合时的 DNA浓度和混合时间、转染时DNA的浓度和转染时间对转染效率及外源基因表达的影响。实验转染条件分别设置为:PEI与DNA的质量比为0.5:1, 1:1, 2:1, 4:1,6:1,PEI与DNA混合时转染复合物中DNA的浓度为5, 10, 20, 40, 60μg/mL,混合时间为 0, 5, 10, 20, 30, 60 min,转染时的DNA浓度为1, 2, 3, 4 μ g/mL,转染持续时间为2, 4, 6, 8, 10, 12 h。
当PEI与DNA质量比为 2:1,转染时DNA浓度为2 μ g/mL,转染时间为6 h时,转染效率即可达到最高,继续增加此3个转染条件的设置值,转染效率不再提高(Fig.2,a、d、e)。而转染复合物中 DNA 浓度和混合时间对转染效率无显著影响(Fig.2,b、c)。
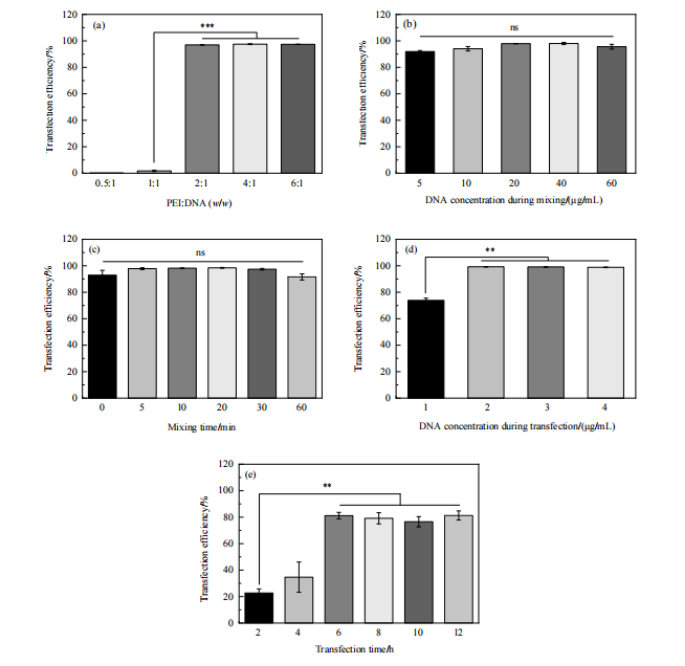
Figure 2 转染条件对转染效率的影响:(a) PEI:DNA;(b) 转染复合物中DNA浓度;(c) 混合时间;(d) 转染时DNA浓度;(e) 转染时间 (**: p<0.01; ***: p<0.001)
当PEI与DNA的比例为2:1时相对荧光强度最大,随上述比例继续增大,相对荧光强度出现了小幅下降(Fig.3, a)、转染时的DNA浓度增大和转染时间延长均有利于外源基因表达(Fig.3, d、e),但较高的DNA浓度将增加生产成本,且在无血清培养条件下长时间转染可能导致细胞活性降低。因此选择2μg/mL的DNA浓度和6 h 的转染时间。转染复合物中DNA浓度和混合时间对基因表达量的影响较小,二者分别为 20μg/mL 和10 min时基因表达量最高(Fig.3, b、c)。
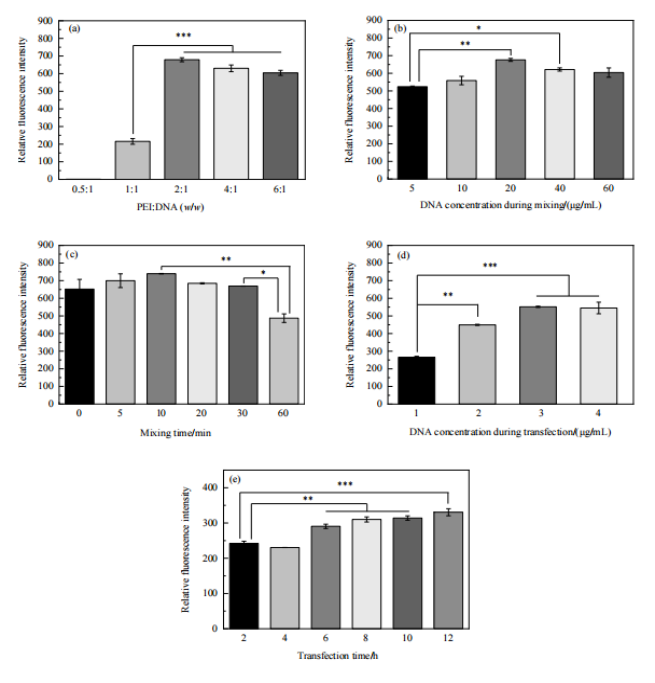
Figure 3 转染条件对基因表达的影响:(a) PEI:DNA;(b) 转染复合物中DNA浓度;(c) 混合时间;(d) 转染时DNA浓度;(e) 转染时间 (*: p<0.05; **: p<0.01; ***: p<0.001)
基于优化后的转染条件,在孔板和载有PET膜材的孔板(即孔板3D固定床模型)中进行慢病毒生产。在孔板中进行细胞培养时,生产的慢病毒滴度较高,可达2.9×107 TU/mL,表明在优化的转染条件下可以生产高滴度的慢病毒。与孔板组相比,孔板3D固定床模型组的慢病毒滴度较低(Fig.4)。考虑到PET膜材具有较高的比表面积,与孔板相比可以支持更多的细胞贴附和生长,因此需优化转染时的细胞密度等参数,以提高收获的慢病毒滴度。

Figure 4 孔板及孔板3D固定床模型生产的慢病毒滴度
随后将PET膜材置于摇瓶中,采用动态培养模型模拟固定床反应器中的培养过程(即摇瓶3D固定床模型),探究接种密度对细胞生长的影响。将 HEK293T 细胞按 2.0×103, 5.0×103, 1.0×104, 5.0×104cells/cm2的密度分别接种至摇瓶中并进行培养。在5.0×104cells/cm2的接种密度下,摇瓶中HEK293T细胞生长良好,细胞在第6天进入指数生长期,第12天时细胞密度最高,达到2.8×106cells/cm2。此后细胞生长进入稳定期(Fig.5)。
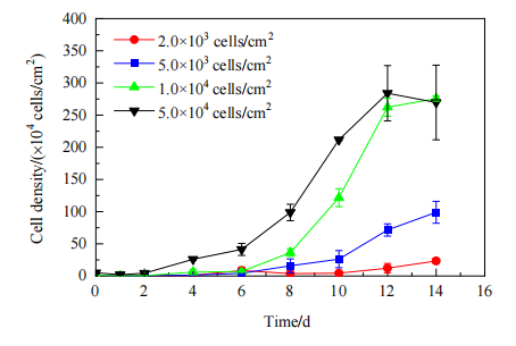
Figure 5 不同接种密度下的HEK293T细胞生长曲线
对不同接种密度下第6, 10和14天的细胞进行活死染色,活细胞被染成绿色,死细胞被染成红色。在较高的接种密度 (1.0×104和5.0×104cells/cm2)下,HEK293T细胞在摇瓶3D固定床模型上的分布较为均匀。培养至第10天时,5.0×104cells/cm2组的细胞已长满整个膜材,活性良好。而接种密度降低,膜材上的细胞呈团簇聚集,不均匀的细胞分布和过低的细胞密度不利于质粒转染和病毒生产。因此后续实验将采用5.0×104cells/cm2的接种密度(Fig.6)。

Figure 6 不同接种密度下的HEK293T细胞活性和分布
随后在摇瓶3D固定床模型细胞密度分别为2.0×105,5.0×105,1.0×106, 2.0×106 cells/cm2时进行转染,考察转染密度对慢病毒生产的影响。转染时细胞密度为 2.0×105和5.0×105cells/cm2时,单细胞产毒量相近,约为0.5 TU/cell。当细胞密度升至 1.0×106cells/cm2时,单细胞产毒量提高至0.8 TU/cell;与其他各组相比,单位体积、单位载体面积、单位细胞的病毒产量均最高。当细胞密度进一步提升时,单细胞产毒量反而下降(Fig.7)。
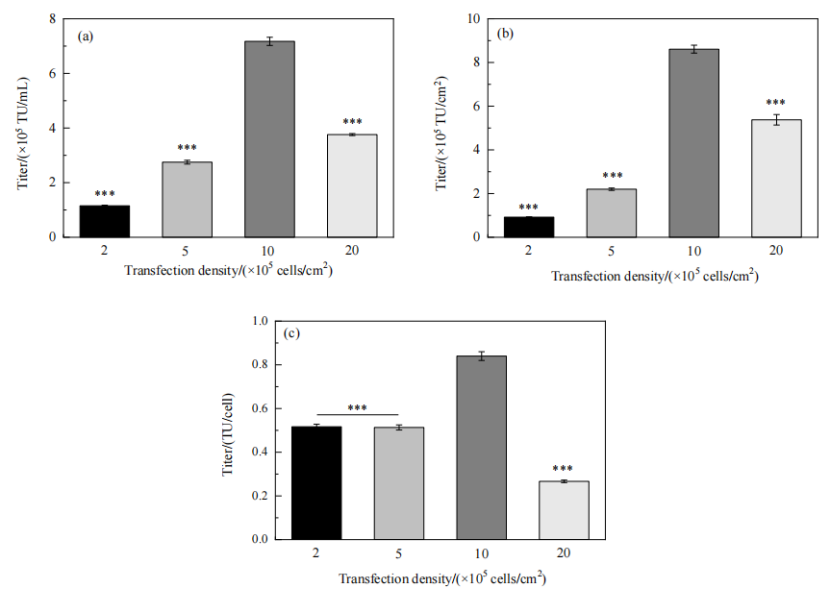
Figure 7 转染时的细胞密度对慢病毒滴度的影响:(a) TU/mL;(b) TU/cm2 ;(c) TU/cell (与“10”对比; ***: p<0.001)
最后在AD60 FBR中应用优化后的转染条件和细胞培养参数进行慢病毒制备,在反应器中以5.0×104 cells/cm2的密度接种细胞,培养期间每天取样,检测细胞生长;当细胞密度达到1.0×106 cells/cm2时进行转染,转染6 h后更换含血清培养基。慢病毒生产期间每天检测培养上清液中葡萄糖浓度。分析AD60 FBR中HEK293T细胞的生长数据(Fig.8),培养第1天时细胞密度为5.7×104 cells/cm2,大于接种密度,表明细胞贴附后开始扩增。在第3天细胞生长进入指数生长期,第5天细胞密度增加至1.0×106 cells/cm2。与摇瓶的培养结果相比,固定床反应器中细胞更快进入指数生长期。
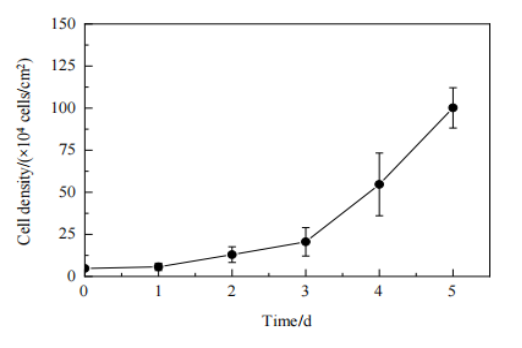
Figure 8 固定床反应器中的细胞生长曲线
对AD60 FBR中生长阶段的细胞活性和分布情况进行了检测(Fig.9)。由图可知,反应器载体填充材料PET膜材是由无序堆积的纤维形成的三维细胞培养载体;除部分纤维较稀疏的区域,细胞经过5天生长后可较均匀地铺满材料,细胞活性良好,未见可观察到的死细胞。表明该接种密度和转染时的细胞密度较为合适,在充分利用PET床面积的同时未导致细胞过度重叠、聚团。
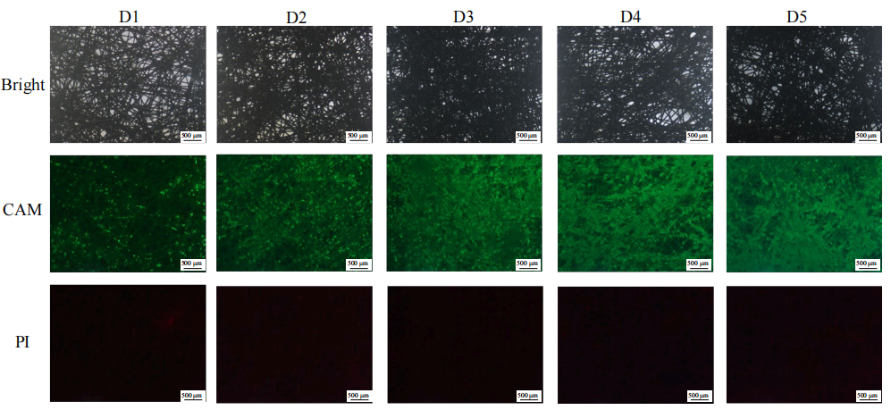
Figure 9 固定床反应器中的细胞分布
对AD60 FBR反应器中生产出的慢病毒进行了滴度检测,在质粒DNA转染后的第3天(即培养第8天),慢病毒滴度显著增加,此时上清液中的病毒滴度可达1.3×107 TU/mL、8.5×106 TU/cm2,单细胞产毒量为 8.5 TU/cell;与之相比,培养第 7 天时,上清液中病毒滴度为 2.5×106 TU/mL、1.7×106 TU/cm2,单细胞产毒量为1.7 TU/cell。培养第7天收获1 L培养上清液,培养第8天收获1.7 L培养上清液,合计收获总病毒量为2.4×1010 TU,平均病毒滴度为8.9×106 TU/mL、9.6×106 TU/cm2 (以2 m2等效面积计算为 1.2×106TU/cm2)和9.6 TU/cell。上述数据证实AD60 FBR生产出的慢病毒滴度较高,表明所优化的转染条件和生产条件支持固定床反应器中慢病毒的高效生产。
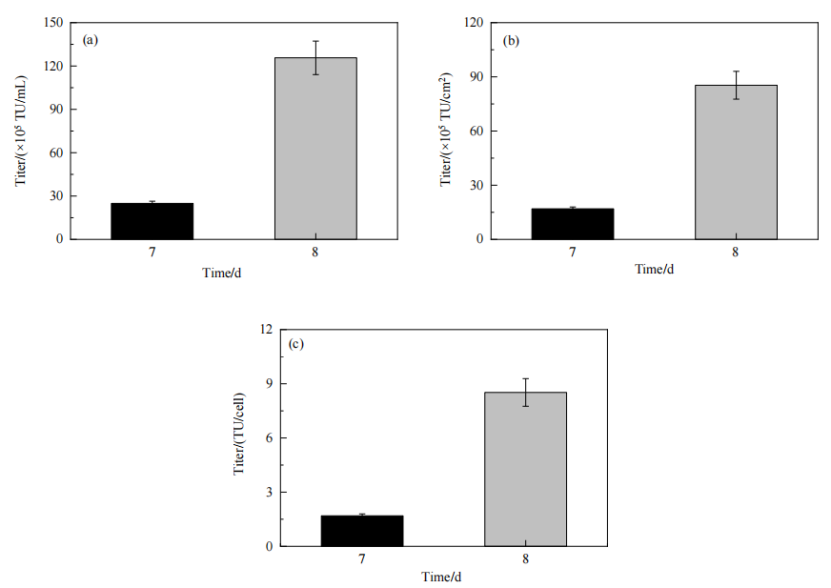
Figure 10 固定床反应器中生产的慢病毒滴度:(a) TU/mL;(b) TU/cm2 ;(c) TU/cell
以CEL-G® Culture Ad60为代表的固定床生物反应器作为细胞大规模贴壁培养的设备,在慢病毒制备领域证实具有巨大的潜力。华东理工大学的研究通过优化质粒转染条件和细胞培养参数,实现了固定床反应器中的高滴度慢病毒生产。相信未来通过工艺进一步优化,AD60 FBR可以为LVs乃至更多病毒载体的大规模制备提供解决方案。并且,随着研究的不断深入,以固定床反应器为基础开发可扩展、经济高效且临床可接受的病毒生产工艺将会成为实现基因和细胞疗法变革的基石。
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
