-
新闻
植物外囊泡:IBD患者的“绿色药箱”,开启肠道健康新纪元
发布日期:2025-03-10
近年来,一种被称为“绿色癌症”的慢性腹泻疾病——炎症性肠病(IBD),正逐渐引起全球关注。这种疾病的起因尚不清楚,导致越来越多的人饱受腹痛、腹泻、甚至便血之苦。炎症性肠病(inflammatory bowel disease,IBD)是一种慢性非特异性和复发性肠道炎症疾病,包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)[1]。IBD的发病机制与遗传、环境、微生物和免疫密切相关[2]。在过去的几十年里,IBD患者的人数已超过500万,近年来其全球发病率有所上升[3],常见治疗手段,临床常用药物包括氨基水杨酸、皮质类固醇、免疫调节剂等,但传统治疗方法副作用大,效果有限,因此,亟需寻找安全有效的治疗方法[4]。正因如此,越来越多的研究证实,植物来源的细胞外囊泡(Plant-Derived Extracellular Vesicles,PDEVs),因其天然、低毒、易获取等优势,更是成为研究热点,作为一种新兴的治疗工具,在一定程度上弥补现有疗法的局限性,在IBD的治疗中展现出巨大的潜力。
2025年2月,浙江省农业科学院、宁波大学和湘湖实验室联合在国际Top期刊《Journal of Advanced Research》(IF=11.4)发表了题为“Therapeutic application and potential mechanism of plant-derived extracellular vesicles in inflammatory bowel disease”的综述论文。文章总结了PDEVs的结构和分类、组成和制备方法,重点梳理了PDEVs对IBD的治疗作用和潜在机制,展望了未来相关研究所面临的挑战和机遇,有助于了解PDEVs对肠道疾病IBD的多重作用和应用潜力,为探索新型IBD治疗策略提供了新视角。

综述亮点:
-
PDEVs调节M1/M2型巨噬细胞极化和阻断炎症小体(NLRP)的组装发挥免疫调节作用。
-
PDEVs通过促进粘液分泌和细胞间粘附连接来修复肠上皮屏障功能。
-
PDEVs可调节微生物多样性和抑制致病细菌生长来重塑IBD患者肠道菌群。
-
PDEVs是功能性营养因子或IBD治疗药物递送的优良载体。
-
PDEVs为IBD提供了一种很有前途的新型治疗策略。
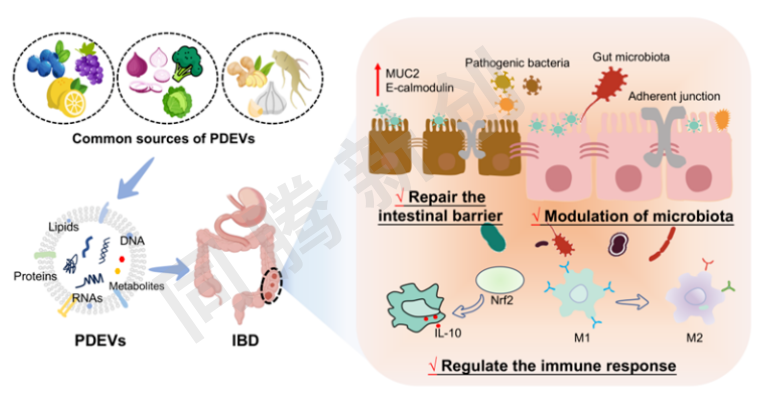
Figure 1. PDEVs在疾病预防和治疗中的多种生物过程调节作用
PDEVs是具有磷脂双层结构的球形囊泡,直径在30-150纳米之间,密度为1.13-1.19 g/mL。它们包含多种生物活性物质,如信号蛋白、脂质、DNA、miRNA和mRNA。PDEVs的摄取和信号转导能力主要取决于它们的来源或状态。此外,它们的分离路径也可能影响其功能。根据其生化途径,PDEVs可分为三类:外泌体(50-150 nm)、微泡(150-1000 nm)和凋亡囊泡(1000-5000 nm)。PDEVs主要从水果、蔬菜和草药中提取,价格实惠且易于获得。在临床实践中,PDEVs因其体积小和出色的组织靶向特性而作为药物载体受到高度重视(Figure 2)。

Figure 2. PDEVs的来源、形成途径和结构特征
健康肠道中的免疫系统和微生物通过适当调节外来抗原来保持恒定的平衡。总体而言,PDEVs作为一个新兴的研究领域,其研究相对不足,作者根据现有文献总结了PDEVs在IBD治疗中的作用及潜在机制,重点是免疫反应的调节、肠上皮屏障功能的修复和肠道微生物群的重塑(Figure 3)。
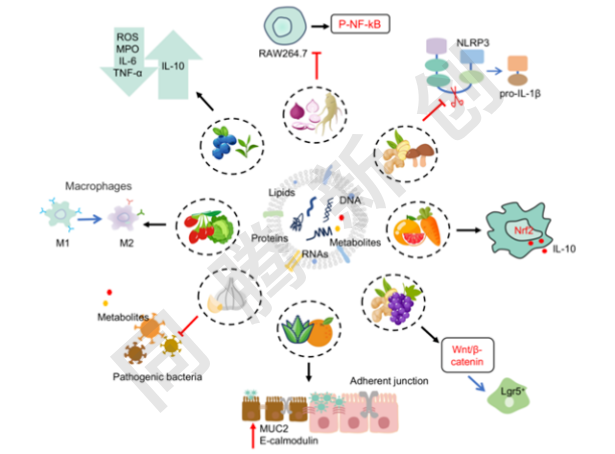
Figure 3. PDEVs治疗IBD的潜在分子作用机制
PDEVs具有天然来源、生物相容性高、稳定性强、生产成本低等特点,能够克服传统合成载体(如脂质体)和动物来源囊泡的局限性。其内容物包括蛋白质、核酸、脂质等生物大分子,能够通过调节免疫反应、抗炎、修复肠道屏障、调节肠道菌群等多种机制发挥治疗作用。
作为药物递送载体,PDEVs在临床实践中展现出极高的应用价值,主要得益于其小尺寸和优异的组织靶向特性。PDEVs能够负载药物、siRNA等治疗分子,实现精准靶向治疗,为IBD等疾病的治疗提供了新的可能性。例如,生姜来源的囊泡能够有效递送siRNA,显著改善溃疡性结肠炎的治疗效果[5]。西兰花来源的囊泡通过调节肠道免疫反应和修复肠道屏障功能,显著减少了结肠组织中的炎症细胞浸润,并改善了肠道通透性,从而缓解IBD的症状[6]。此外,芦荟来源的囊泡通过抑制NF-κB信号通路和促进肠道上皮细胞增殖,显著改善了小鼠结肠炎模型的病理评分,增强了肠道屏障功能,有效缓解IBD的症状[7]。同样,葡萄柚来源的囊泡通过调节肠道微生态和增强肠道屏障功能,显著减少了结肠组织中的炎症细胞浸润,并改善了肠道通透性,从而有效缓解IBD的症状[8]。

Figure 4. 可分泌调节肠道功能外囊泡的植物
尽管PDEVs在IBD治疗中展现出巨大潜力,但仍面临一些挑战。不同的植物,不同的部位,不同的分离方法影响得率和纯度。值得注意的是,由于PDEVs体积小且成分复杂,因此提取PDEVs具有挑战性。在自然状态下,PDEVs分布在复杂的基质中,这需要合适的提取和纯化方法。长期以来,PDEVs最常见方法是超速离心(UC),由于这种高速和长期的机械作,PDEVs的形态结构很容易变形,甚至可能破裂。此外,其他分离方法,例如:密度梯度离心法(DGC)、沉淀法等,存在耗时长或引入其他杂质,影响所获得的PDEVs的下游分析。总的来说,传统的每种方法都有其优点和缺点。理想的提取方法应保持PDEVs的活性和完整性,而不引入外源性化合物,尤其是有毒物质。因此,亟需要一种简化的提取方法,以提高产量,同时保持纯度。
同腾新创高效切向流技术
进行大规模PDEVs分离和纯化
为了满足科研和临床的需求,加快外囊泡行业的发展,同腾新创开发了CEL-G® TFF Lab系列外泌体浓缩系统(TFF Lab)(Figure 5)。

Figure 5. CEL-G®TFF Lab系列外泌体浓缩系统
TFF Lab系统基于三级分离原理,能够实现外泌体的规模化自动化浓缩富集,具备高效、便捷和高度自动化的特点。该系统可根据用户需求灵活调节收获体积,并对整个过程的参数进行实时监控,同时严格遵循GMP规范。系统配备控制器主机、直观的人机交互界面以及一次性封装耗材包,可实现外泌体的实时监测和定量收获,具有耗时短、效率高、高倍浓缩等优势。整个处理过程运行静音、安全且顺畅,分离得到的外泌体完全符合相关鉴定标准。
TFF Lab系统可用于分离提取各类细胞来源和植物来源的外泌体(Figure 6),能够显著提升植物来源外囊泡(PDEVs)的产量和纯度,且适合PDEVs的大规模生产,同时能够有效保持其生物学活性和完整性。

Figure 6. TFF Lab 可分离纯化的外泌体来源及种类
TFF Lab切向流提取植物外囊泡(PDEVs)具有以下显著优势:
切向流过滤(Tangential Flow Filtration, TFF),亦称错流过滤或横流过滤,是一种高效、灵活的液体处理技术。它能够连续处理大量样品,短时间内快速处理植物样本。其独特的切向作用流过滤膜可减少对外泌体的机械应力,从而显著提高分离效率。
该技术在相对温和的条件下进行,避免了化学分离方法中常用的强酸、强碱或有机溶剂,能够更好地维持PDEVs的完整性和生物学活性,为后续的功能和成分研究提供高质量的样本。
通过选择合适孔径的过滤膜,TFF Lab能够根据PDEVs的大小将其与细胞碎片、蛋白质、核酸等杂质有效分离,实现对特定大小PDEVs的精准分离和富集,从而获得高纯度的外泌体,为深入研究植物外泌体的组成和功能提供有力支持。
TFF Lab系统高度自动化,可实现“浓缩、缓冲液置换、收获、清洗”一键启动。操作人员易于掌握,减少了人为误差,缩短了分离时间,确保分离过程的稳定性和可靠性。在相同条件下,可多次获得一致的PDEVs分离结果,便于不同实验批次之间的比较和验证。
该技术适用于多种植物,无论是草本植物还是木本植物,其PDEVs均能通过切向流分离技术高效分离,展现出良好的适应性和广泛的应用前景。
TFF Lab具有高度可扩展性,适合大规模生产PDEVs。通过优化过滤条件和设备设计,可在短时间内处理大体积样本,日处理量可达百升以上,满足实验室研究和工业生产的双重需求,为PDEVs的规模化制备提供了新的高效途径。
总结
IBD是一种慢性、复发性的肠道疾病,传统治疗方法往往效果有限且存在较大副作用。近年来, PDEVs凭借其天然、低毒、易获取的特性,逐渐成为IBD治疗的新希望。PDEVs通过多种机制发挥作用,包括调节免疫反应、修复肠上皮屏障以及重塑肠道菌群,展现出巨大的治疗潜力。尽管在分离和纯化方面仍面临诸多挑战,但同腾新创开发的TFF Lab系统为PDEVs的大规模生产提供了高效且无损的解决方案。随着相关研究的不断深入,植物外泌体有望成为IBD治疗的重要工具,为患者带来更安全、更有效的治疗选择。
[1] Fabián O, Kamaradová K. Morphology of inflammatory bowel diseases (IBD) [J]. Cesk Patol, 2022, 58(1): 27-37.
[2] 孟欢, 侯晓婷, 张华敏, 等. 中药天然产物治疗炎症性肠病的研究进展[J]. 中草药, 2023, 54(10): 3349-3369.
[3] Li J, Luo T, Wang D, Zhao Y, Jin Y, Yang G, Zhang X. Therapeutic application and potential mechanism of plant-derived extracellular vesicles in inflammatory bowel disease. J Adv Res. 2025 Feb;68:63-74. doi: 10.1016/j.jare.2024.01.035. Epub 2024 Feb 9. PMID: 38341033; PMCID: PMC11785581.
[4] REN Yuan1, HE Min1, ZENG Qian1, ZENG Wen1, HE Weiwei1, HE Yongheng2, TANG Xiaojuan2, LI Yongmin2 Efficacy and mechanism evaluation, and medicinal development prospects of plant-derived vesicles in therapeutics of inflammatory bowel disease DOI: 10.7501/j.issn.0253-2670.2024.23.026
[5] Teng Y, Ren Y, Sayed M, Hu X, Lei C, Kumar A, Hutchins E, Mu J, Deng Z, Luo C, Sundaram K, Sriwastva MK, Zhang L, Hsieh M, Reiman R, Haribabu B, Yan J, Jala VR, Miller DM, Van Keuren-Jensen K, Merchant ML, McClain CJ, Park JW, Egilmez NK, Zhang HG. Plant-Derived Exosomal MicroRNAs Shape the Gut Microbiota. Cell Host Microbe. 2018 Nov 14;24(5):637-652.e8. doi: 10.1016/j.chom.2018.10.001. Epub 2018 Oct 25. PMID: 30449315; PMCID: PMC6746408.
[6] Zhang, Y., Wang, X., & Li, M. (2022).Broccoli-derived exosomes as a potential therapeutic agent for inflammatory bowel disease.Journal of Agricultural and Food Chemistry, 70(15), 4567–4578.DOI:10.1021/acs.jafc.2c01234
[7] Liu, J., Chen, H., & Zhang, L. (2021).Aloe vera-derived exosomes as a novel therapeutic approach for inflammatory bowel disease.Phytomedicine, 85, 153535.DOI:10.1016/j.phymed.2021.153535
[8] Wang, Q., Sun, Y., & Zhang, X. (2023).Grapefruit-derived nanovectors for targeted delivery of therapeutics in inflammatory bowel disease.Nature Communications, 14(1), 1234.DOI:10.1038/s41467-023-36912-3
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
