-
新闻
案例应用丨慢病毒生产界的“光速引擎”!CEL-G® Culture Ad60 固定床反应器让转染效率飞起来!
发布日期:2025-03-07
在细胞和基因治疗领域,以HIV-1为基础发展起来的慢病毒载体(Lentivirus,LVs),因具有能稳定表达外源基因、感染范围广泛、可感染处于分裂期和静止期的细胞等特性,成为了临床研究的理想载体选择。目前,临床试验需要大量的功能性慢病毒颗粒,而LVs的大规模制备当下具有一定挑战性,解决方案是开发和优化相关的制备工艺,通过优化细胞密度、质粒用量及配比、转染试剂选择及用量等转染参数以克服当前上游工艺的局限性,而固定床反应器被引入其中并逐渐展现出优于传统的二维培养平台(培养皿、细胞工厂)的扩展性及病毒量产出。本实验研究并优化了使用6孔板、6孔板3D固定床模型和CEL-G® Culture Ad60固定床反应器(Ad60 FBR)瞬时转染LVs包装质粒(TT-CP1,含绿色荧光蛋白copGFP)的工艺策略,经过优化放大测试,TT-CP1质粒在AD60 FBR中成功产出表达,该质粒copGFP最强荧光表达量对应的转染条件为细胞密度1E5 cells/cm2、DNA用量2 pg/cell、PEI与DNA比例为2:1。未来通过进一步病毒包装测试,AD60 FBR可以为LVs制造提供潜在的规模扩大解决方案。
LVs是在人免疫缺陷病毒(HIV-1病毒)基础上改造而成的病毒载体系统,是属于逆转录病毒的一个属,它能高效的将目的基因(或RNAi)导入动物和人的原代细胞或细胞系,对分裂细胞和非分裂细胞均具有感染能力。LVs基因组是单股正链RNA,其基因组进入细胞后,在细胞质中被其自身携带的反转录酶反转为DNA,形成DNA整合前复合体,进入细胞核后,DNA整合到细胞基因组中。整合后的DNA转录成mRNA,回到细胞质中,表达目的基因。另外LVs删除了HIV病毒绝大多数基因,仅保留了HIV病毒的LTR序列,包装信号,Rev应答原件等。因此免疫原性低,在注射部位无细胞免疫反应,体液免疫反应也较低,不影响病毒载体的第2次注射。
第一代基于HIV的LVs将病毒的必要成分分离成两个质粒。经过几次修饰,目前广泛使用的是第三代LVs(Fig.1),它由四个独立的质粒组成:两个包装质粒rev和gag-pol,其中rev编码用于病毒基因组输出的蛋白质表达,gag-pol分别表达病毒衣壳结构蛋白和逆转录酶、整合酶和蛋白酶;一个包膜质粒编码糖蛋白,其中来源于介导病毒细胞进入的水泡性口炎病毒包膜糖蛋白(VSV-G)较为常用;其中最为重要的GOI质粒包含临床或研究目的的转基因序列,出于安全考量,GOI质粒的的LTR区域经过删减改造,复能能力并不完全,病毒在插入到宿主基因组后会自我失活(self-inactivating,SIN)。

Figure 1.第三代慢病毒载体质粒示意图
截至目前,超过2500项涉及LVs的临床试验正在进行中,共有12种相关的CAR-T体外基因疗法已被批准(Table 1)。2017年,FDA批准Kymriah(诺华)用于治疗25岁以下患有B细胞前体急性淋巴细胞白血病(ALL)的难治性或二次或更晚复发的患者,随后Yescarta(吉利德)被批准用于治疗复发或难治性大B细胞淋巴瘤,Tecartus(吉利德)、Breyanzi(百世贵施贵宝)、Abecama(蓝鸟)等CAR-T产品也在美国逐渐上市,中国首款产品奕凯达(复兴凯特)在2021年6月获评,用于治疗成人复发或难治性大B细胞淋巴瘤,截止目前中国境内已有5款基于慢病毒的CAR-T产品上市。

细胞及基因治疗从研发到临床研究的快速发展,提高了对病毒载体大规模制备解决方案的需求,另外LVs制备过程中的高成本也是一个障碍。为了解决这些需求,必须建立可扩展的、成本有效的和可重复的LVs生产方法。虽然悬浮细胞的应用越来越广泛,但LVs的制备综合下游纯化工艺的限制目前仍然只适用于细胞贴壁培养体系多质粒瞬时转染工艺,传统的二维贴壁培养体系虽然可以支持小批量的研究水平的病毒制备,甚至可以满足临床阶段早期的需求,然而II期及以后的临床试验,都需要大规模制备高滴度的病毒载体,仅使用培养瓶或10至40层细胞工厂从包装细胞系中生产LVs具有多重限制,其中包括且不限于收获时间限定较紧、人工劳动强度大、系统操作多为开放式并且需要大量的培养箱空间,这些限制为后续商业化规模的病毒制备带来了压力,为了克服当前工艺的局限性,固定床反应器这种扩展性高的三维贴壁培养体系正在逐渐应用流行。
其中Ad60 FBR填充有固定化细胞的固相载体PET膜材料(Fig.2),可以为细胞贴附生长提供适宜的介质类型、气体控制、温度控制及pH控制等多重精细化支持。当细胞被搅拌驱动拦截在双层螺旋缠绕的PET膜材空隙中时,培养液流经后与细胞进行传质传氧,这种培养方式极大的避免了搅拌引发的剪切力及碰撞造成的细胞损伤等。相对于细胞工厂而言,固定床反应器有着明显的培养面积优势,AD60 FBR培养面积设计为1 m2/2 m2、20 m2以及60 m2,对应的细胞工厂层数(细胞工厂每层培养表面积0.063m2)分别是16/32层、320层以及950层,放大规模的AD600 FBR培养面积则高达300 m2/600 m2,对应的细胞工厂层数更是达到了4800层/9600层。另外细胞在AD60 FBR培养过程中的分布十分均匀,能对后续批次重复及放大提供稳定性与重复性支持,从而能加快产品上市速度。

Figure 2.AD60 FBR反应器及载体膜材示意图
LVs制备过程中有许多工艺参数可以优化改进以提高病毒产量。包装细胞选择、转染试剂选择及用量、细胞培养扩增工艺、质粒构建情况和用量配比以及下游的过滤和纯化步骤均能够直接影响病毒载体的产量,其中最为重要的工艺限速步骤即是转染路线及转染工艺参数的选择。首先是选择合适的培养和扩增包装细胞系(PCL)以获得足够的细胞量,目前易于转染并适应不同的培养策略的HEK293细胞系是LVs生产的理想选择。其次是将质粒转染到包装细胞中产生病毒载体颗粒,LVs载体的表达有瞬时转染和稳转两种工艺路线,然而目前稳转株构建成本高昂且耗时(通常需要几个月的构建周期),相比较而言瞬时转染快速而简单是从包装细胞中获得病毒颗粒的最容易的方法,瞬时转染将三个或四个独立的转录单位的质粒转染进入同一包装细胞中用以高表达所需要的病毒序列,因此转染时细胞量、质粒的用量及不同质粒的配比均能够明显影响病毒的产出。转染试剂的选择有磷酸钙(CaPO4)、Lipofectamine和聚乙烯亚胺(PEI)等,其中PEI转染可以在无血清条件下使用具有明显的使用优势。最后还需要考量转染后将PCL继续培养产生足够数量的病毒颗粒并选择在合适的收获时间进行病毒收获。
测试荧光质粒TT-CP1在Ad60 FBR固定床反应上的转染效果,确定前期小试工艺的放大可行性,为后续LVs的制备工艺提供一定的数据支撑。细胞:HEK 293T(ATCC),质粒:TT-CP1(金斯瑞合成),转染试剂:PEI(Polysciences),培养基:DMEM(源培)、Opti-MEM(Gibco),血清:FBS(源培),6孔板(NEST),6孔板固定床模型(填充材料为PET膜材,同腾),AD60 FBR(同腾)。
质粒转染瞬时表达研究分别在6孔板,6孔板3D固定床模型和AD60FBR上进行。
首先在6孔板层面测试了TT-CP1质粒的copGFP表达情况(Fig.3),通过Design Expert实验设计,以细胞转染密度1-2 E5cells/cm2、质粒用量1-2 pg/cell及转染试剂与质粒用量比例1:1-2:1等条件范围预设了不同的转染组,通过对比不同实验组荧光表达量参数,虽然响应面分析荧光表达相应顶点出现在了预设条件边缘,但减少细胞密度、增加转染试剂用量及质粒用量会造成更大的细胞毒性影响及游离质粒量,因此结合预测分析,确定在预测条件范围内,HEK 293T细胞在1E5 cells/cm2转染密度、DNA用量2 pg/cell、PEI:DNA为2:1的条件下,荧光表达效果最优。

Figure 3.(a)不同实验组之间绿色荧光蛋白表达荧光分析、(b)响应面数据分析,随PEI用量增加荧光强度随之增加,实验组未出现穹隆状数据,有极值出现在实验设计水平顶端、(c)DOE预测最优荧光强度工艺条件为1E5 cells/cm2转染密度、DNA用量2 pg/cell、PEI:DNA为2:1。
其次,测试了TT-CP1在6孔板3D固定床模型上的转染效果(Fig.4),通过在6孔板中铺设单层、双层及三层PET膜材,接种HEK 293T细胞后,进行质粒转染,荧光表达情况如图所示,荧光观察发现细胞在膜材上贴附率高,膜上的copGFP表达明显。另外多层膜材时存在明显的细胞分布不均匀,双层膜下层,三层膜中层下层细胞未见明显荧光表达。该实验为后续PET膜材的AD60 FBR质粒转染提供了小试数据参考,后续实验开展工艺参数可依照此工艺进行放大。

Figure 4.6孔板3D固定床模型质粒转染荧光表达情况。
AD60 FBR荧光质粒转染结果分析,固定床培养面积2 m2,HEK 293T细胞上罐密度为2.5E4cells/cm2,培养基为DMEM完全培养基(DMEM+10% FBS)。细胞培养48h后,细胞密度为1.1 E5 cells/cm2时进行了质粒转染,按照转染复合物配置表(Table2)配转染复合物,分别将DNA及PEI溶液加入到Opti-MEM中,随后将PEI溶液加入至DNA溶液形成转染复合物,复合物室温下静置孵育10 min,随后将孵育后的转染复合物打入固定床反应器,将转染后的体系继续培养16 h后,排空罐体更换为无血清DMEM继续培养。

培养过程细胞密度及游离细胞密度、细胞代谢情况生化测试结果如图(Fig.5)所示,D2进行了质粒转染,D3更换为了无血清培养基,D4-D5即转染后48-72h,固定床反应器膜上细胞密度出现了一定程度降低,LDH升高现象,表明培养过程中膜上细胞出现了脱落情况。

Figure 5.固定床反应器荧光质粒转染培养条件情况监测
对细胞培养及荧光质粒转染不同时间节点的膜材培养取样条及培养上清进行了荧光检测分析(Fig.6,a),转染24h时能明显观察到copGFP的表达,转染48h荧光强度达到最高,72h荧光强度出现一定程度降低,并在72h上清液中观测到了荧光存在,证明了部分细胞出现脱落现象,该荧光结果与上述游离细胞增加数据及LDH变化趋势能够相互照应,出现此情况原因可能为转染16h后更换为了无血清培养基导致的细胞贴附性降低。并对不同时间节点的取样条裂解液进行了荧光强度变化情况分析(Fig.6,b),0h与24/48/72h荧光强度均有显著性差异,表明copGFP能够在固定床反应器中表达,确证转染效果,72h裂解液荧光强度略有下降,验证细胞脱落情况。
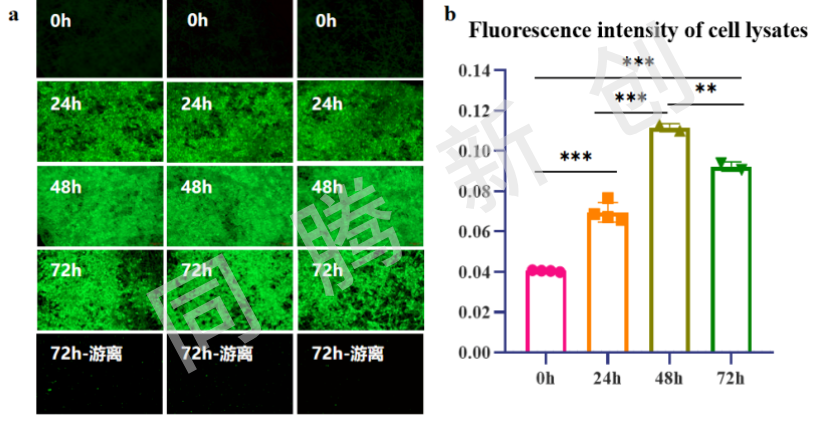
Figure 6.(a)不同时间节点的膜材培养取样条及上清荧光检测(b)不同时间节点的取样条裂解液进行了荧光强度变化情况
固定床生物反应器具有更高的生产效率、操作过程简化、自动化程度高、在线监测、培养条件调节灵活、空间需求低和总体更低的风险特征,能够在病毒载体制备过程中发挥巨大优势。本实验将研究重点放在了质粒转染工艺在AD60 FBR层面的开发及测试上,实验结果表明,HEK 293T细胞密度1E5 cells/cm2、DNA用量2 pg/cell、PEI与DNA比例为2:1条件时,LVs的包装质粒在AD60 FBR中具有良好的表达效果。未来通过工艺进一步优化,AD60 FBR可以为LVs制造提供规模扩大解决方案。并且,随着该领域的不断发展,以固定床反应器为基础开发可扩展、经济高效且临床可接受的LVs制造工艺对于实现基因和细胞疗法的变革潜力将是必不可少的。
1、Eduardo, Martínez-Molina,Carlos, Chocarro-Wrona,Daniel et al. Large-Scale Production of Lentiviral Vectors: Current Perspectives and Challenges.[J] .Pharmaceutics, 2020, 12: 0.
2、Alexandra, McCarron,Martin, Donnelley,Chantelle et al. Transient Lentiviral Vector Production Using a Packed-Bed Bioreactor System.[J] .Hum Gene Ther Methods, 2019, 30: 0.
3、Hanna P, Lesch,Piia, Valonen,Minna et al. Evaluation of the Single-Use Fixed-Bed Bioreactors in Scalable Virus Production.[J] .Biotechnol J, 2020, 16: 0.
- 021-50826962
- sales@ttbiotech.com
-
江苏省苏州市太仓市昭溪路90号
